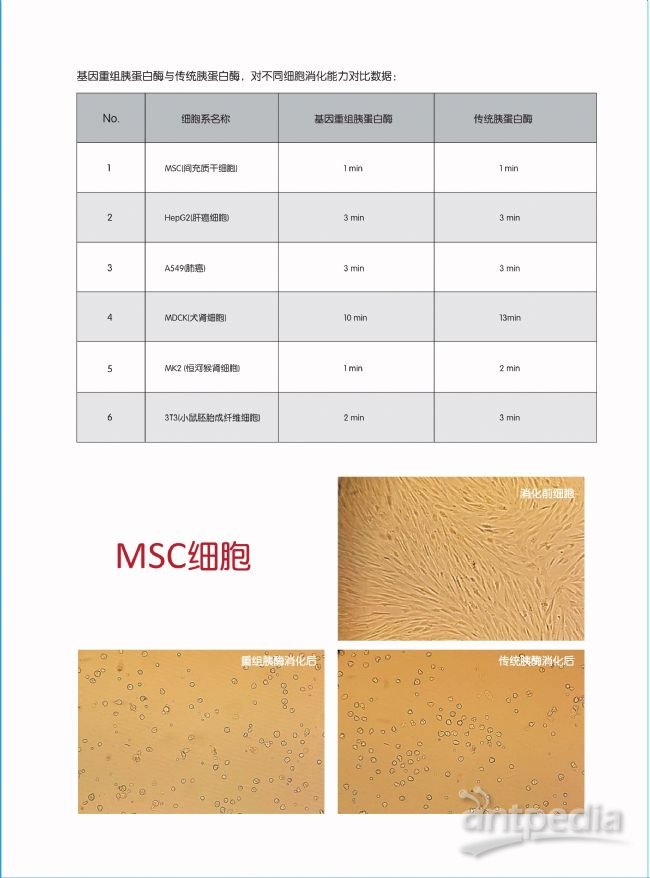
基因重组胰蛋白酶与传统胰酶的消化对比
胰蛋白酶(Trypsin)是一种丝氨酸蛋白水解酶。其前体为无生物活性的胰蛋白酶原(trypsinogen),产生于胰脏。随胰液分泌到小肠中,被小肠中的肠肽酶激活后,能将蛋白质分解为多肽,进而分解成为氨基酸。其切割肽链的位点主要位于赖氨酸或精氨酸的羧基端。故在体外细胞培养中,胰蛋白酶被用于消化贴壁细胞以获得相互分离的单个细胞。
传统使用的胰蛋白酶,取自牛、猪或羊的胰脏,经后期的纯化结晶而得。动物来源与生产工艺先天决定了传统胰蛋白酶有较高的外源病毒污染与杂酶污染的可能性,无法应用于生物制药与细胞治疗等临床领域。并且需要-20℃保存。
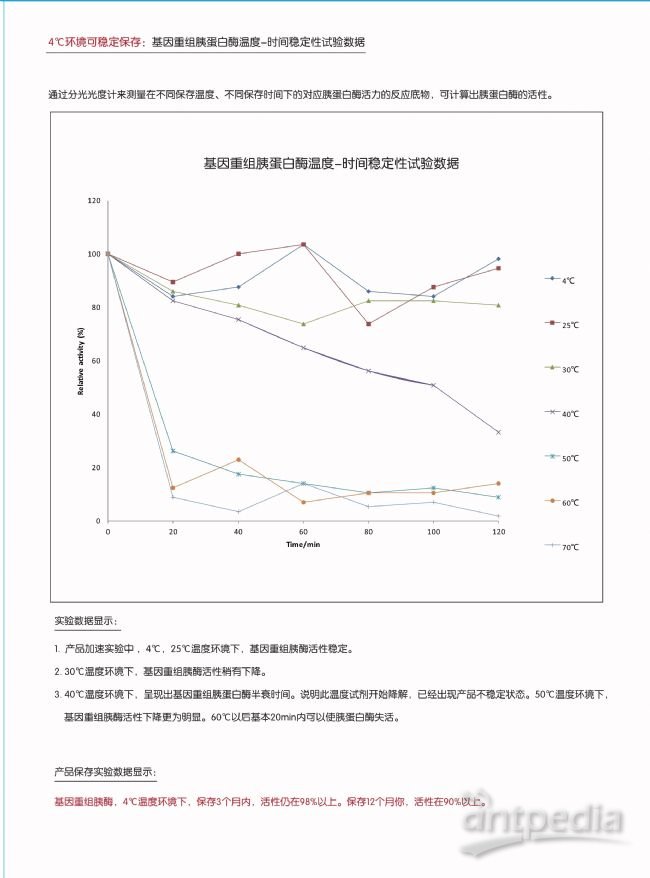
基因重组胰蛋白酶,是由重组大肠杆菌表达生产,氨基酸序列与猪胰腺来源的阳离子型胰蛋白酶完全一致。酶切特异性相同。分子量为24kD,最适pH为7-10。除了具有传统天然胰酶所具有的消化切割肽链的功能外(细胞间的蛋白消化),由于其并不是源于猪、牛或羊的胰脏,所以产品不含任何动物来源组分,也由于重组蛋白生产的产物单一性特点,产物中除了胰蛋白酶,没有传统胰酶中不可避免的糜蛋白酶等组分。另外,特有的对重组蛋白甲基化修饰的非ZL保密生产工艺设计,使得重组蛋白的温度稳定性大为提高,产品可以稳定的保存在2-8℃环境中。无需-20℃保存。
基因重组胰蛋白酶的特点:
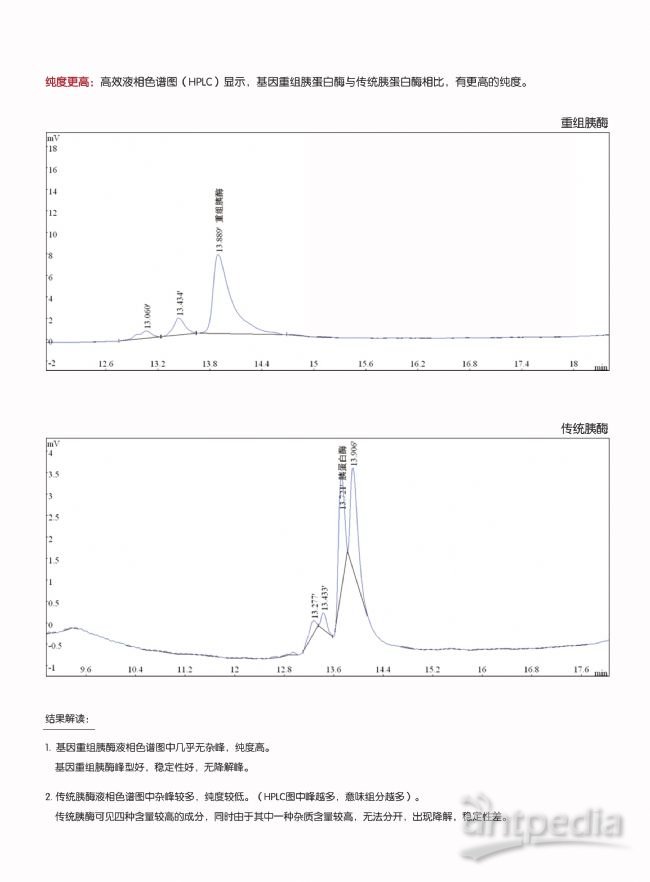
1. 纯度更高、杂质更少,无动物源组分。
2. 2-8℃保存,无需-20℃保存,即取即用,无需等待。
3.消化能力强,作用温和。

推荐