肿瘤外泌体的作用与机制最新研究进展
外泌体(exosome)是由大多数类型细胞分泌的微小膜囊泡,最早是指多囊泡胞内体(multivesicular endosome, MVE)的细胞区室与细胞膜融合后,释放到细胞外基质中的一种直径约30~120nm 的膜囊泡,现特指直径为30~100nm的膜囊泡。
外泌体的第一次发现是在将近40年前,当初人们仅仅认为它是垃圾桶,它的作用是丢弃不想要的细胞组分。但是,此后,越来越多的证据表明外泌体也作为信使,竟然传递信息到相隔较远的组织。外泌体含有细胞特异性的蛋白质、脂质和遗传物质可被运送到其他的细胞,从而改变它们的功能和生理。外泌体形成的第一步是MVE通过向内出芽的方式形成内囊泡,这些内囊泡含有脂质、蛋白、mRNA和miRNA。

外泌体形成过程,图片来自Journal of Cell Biology, doi:10.1083/jcb.201211138。
外泌体可以与摄入它的靶细胞发生相互作用,要么能够有助于防御疾病,要么在一些情况下恶化疾病。比如,成熟的树突细胞分泌的外泌体携带抗原,能够诱导抗原特异性的免疫反应。相反地,病原性的分枝杆菌菌株感染的巨噬细胞释放的外泌体抑制巨噬细胞激活和细胞因子释放,因而抑制将由分枝杆菌抗原诱导的免疫反应。
除了免疫系统之外,外泌体可能影响其他的生理功能。神经细胞、上皮细胞、肌细胞和干细胞分泌的外泌体可能存在的功能包括促进组织修复、神经系统内通信以及诸如朊病毒蛋白之类的病理性蛋白的形成和转移。
然而,越来越多的科学家们也对肿瘤细胞分泌的外泌体越来越感兴趣。90%以上的癌症患者死于肿瘤转移。肿瘤转移指的是从原发性肿瘤上脱落下来的肿瘤细胞,经过血液循环到达新的位点形成转移病灶。血液循环中的肿瘤细胞(CTC)要到达新的位点,肿瘤细胞分泌的外泌体发挥的作用至关重要。外泌体可参与到身体免疫应答、抗原提呈、细胞迁移、细胞分化、肿瘤侵袭等方方面面。
(1)肿瘤免疫中外泌体的作用
肿瘤细胞分泌的外泌体(下称肿瘤外泌体)携带来自肿瘤的抗原,能够被树突细胞捕获并被用来呈递肿瘤抗原,从而激活靶向这种癌症的免疫细胞。然而,这些外泌体也含有各种各样的免疫抑制分子,而且这些分子要么能够使得T淋巴细胞或自然杀伤细胞失活,要么促进抑制免疫反应的调节性T淋巴细胞或骨髓细胞的分化。肿瘤外泌体是肿瘤细胞与其微环境之间相互作用的重要介质,它们通过共享遗传信息或功能蛋白来调节细胞行为。肿瘤外泌体参与上皮间质转化(EMT)、肿瘤血管生成、肿瘤转移和放化疗抗性的调节。几个研究小组的研究结果已经表明肿瘤分泌的外泌体通过抑制抗肿瘤免疫反应,或者通过在肿瘤转移过程中促进血管生成或肿瘤迁移到身体其他部分的方式,从而促进肿瘤生长。
2018年12月,鉴于低氧是实体瘤的一个常见特征并且被认为改变肿瘤外泌体含量,Ling Li等人发现肿瘤外泌体以一种依赖于HSP70但不依赖于树突细胞的方式改变γδT细胞的增殖和细胞毒性。常氧诱导的肿瘤外泌体具有对γδT细胞活性的刺激作用,但是低氧诱导的肿瘤外泌体缺乏对γδT细胞活性的刺激作用,因而这会加强髓系抑制细胞(MDSC)通过miR-21/PTEN/PD-L1调节轴对γδT细胞的抑制作用。再者,有免疫活性的罹患口腔鳞状细胞癌(OSCC)的小鼠受益于联合靶向miR-21和PD-L1的疗法。这就表明肿瘤微环境中的氧气压力通过改变肿瘤外泌体含量来协调抗肿瘤的γδT细胞和促肿瘤的γδT细胞之间的平衡,这随后通过一种依赖于miR-21/PTEN/PD-L1轴的方式调节MDSC功能。
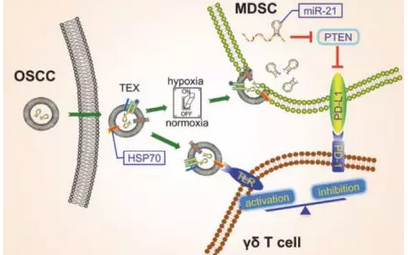
肿瘤外泌体与γδT细胞与MDSC的作用示意图,图片来自Oncogene, doi: 10.1038/s41388-018-0627-z。
2018年12月,Linsen Ye等人利用流式细胞术分析确定了51例肝细胞癌(HCC)患者样本中TIM-1+调节性B(Breg)细胞的数量、表型和功能。他们揭示了肿瘤外泌体HMGB1通过促进TIM-1+调节性B细胞增殖来促进HCC逃避免疫识别,并为以一种依赖于HMGB1-TLR2/4-MAPK途径的方式利用这些外泌体预防和治疗HCC的免疫耐受性提供概念验证。
(2)外泌体中的miRNA与肿瘤转移
外泌体miRNA已在多个研究中被证实有助于多种类型肿瘤的免疫调节、化疗耐药和转移。
2018年12月,Yuan Zhou等人发现HCC癌细胞表现出更大的将正常的肝星状细胞(HSC)转化为癌症相关成纤维细胞(CAF)的能力。再者,他们揭示出HCC癌细胞分析直接靶向PTEN的外泌体miRNA-21,从而导致HSC细胞中的PDK1/AKT信号转导通路激活。活化的CAF通过分析血管生成细胞因子(包括VEGF、MMP2、MMP9、bFGF和TGF-β)进一步促进癌症进展。这些临床数据表明高水平的血清外泌体miRNA-21与HCC患者中的CAF更强活化和更高的血管密度有关。总之,他们为预防和治疗肝癌提供了潜在的靶标。
2018年12月,Zhicheng Zeng等人发现作为一种促进结直肠癌(CRC)转移的miRNA, miR-25-3p可通过外泌体从CRC癌细胞转移到血管内皮细胞中。在发生癌症转移的CRC患者中,来自循环外泌体的miR-25-3p表达水平显著高于未发生癌症转移的CRC患者。这些结果表明外泌体miR-25-3p参与肿瘤转移前微环境(pre-metastatic niche)形成,可能用作一种预测CRC转移的血液生物标志物。
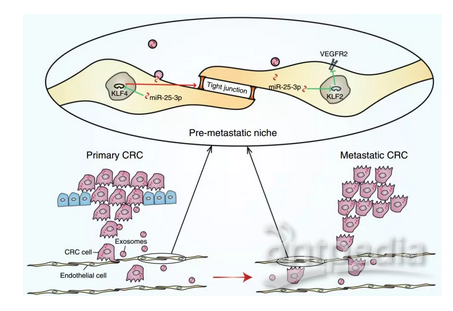
结直肠癌外泌体中的miR-25-3p参与肿瘤转移前微环境形成,图片来自Nature Communications, doi:10.1038/s41467-018-07810-w。
2018年12月,Haiyang Zhang等人发现脂肪细胞分泌的外泌体调节HCC中的去泛素化,并观察到一种称为circ-DB的circRNA在具有较高体脂比的HCC患者中发生上调。再者,体内和体外研究表明exo-circ-DB通过抑制miR-34a和激活去泛素化相关USP7来促进HCC生长并降低DNA损伤。最后,这些结果表明脂肪细胞分泌的外泌体对HCC癌细胞的作用能够通过敲降circ-DB来加以逆转。总之,它们表明由脂肪细胞分泌的外泌体circRNA通过抑制miR-34a和激活USP7/Cyclin A2信号转导通路来促进肿瘤生长和降低DNA损伤。
(3)癌细胞外泌体中的PD-L1
2018年8月,Gang Chen等人发现癌细胞释放生物“无人机”---在血液中循环的被称作外泌体(exosome)的小囊泡,这些外泌体也在它们的表面上携带着PD-L1。外泌体PD-L1可直接结合T细胞并抑制这些T细胞的功能。尽管这项研究主要针对转移性黑色素瘤,但是这些研究人员发现乳腺癌和肺癌也会释放携带着PD-L1的外泌体。鉴定出肿瘤细胞分泌的外泌体PD-L1为免疫检查点机制提供了一次重大更新,并对肿瘤免疫逃避提供了新见解。这项研究以一种颠覆现有观念的方式展示了癌症如何采取一种系统性方法来抑制免疫系统。此外,它还指出了一种新方法来预测哪些癌症患者会对通过破坏免疫抑制来抵抗肿瘤的抗PD1疗法(anti-PD1 therapy)作出反应,并提供一种追踪这类疗法治疗效果的方法。
(4)外泌体与肿瘤微环境
2018年12月,Xiaofan Guo等人报道低氧诱导的神经胶质瘤细胞能够通过将外泌体miR-29a和miR-92a转移到MDSC中来促进功能性的MDSC分化。他们发现低氧诱导的神经胶质瘤来源的外泌体(即神经胶质瘤外泌体)要比常氧诱导的神经胶质瘤外泌体表现出更强的MDSC诱导能力。低氧诱导的外泌体miR-29a和miR-92a表达促进MDSC增殖,而且miR-29a和miR-92a通过分别靶向Hbp1和Prkar1a来激活MDSC的增殖和功能。总而言之,这些研究结果针对神经胶质瘤外泌体中的miRNA在免疫抑制性微环境中的作用提出了新的见解,而且阐明了基于miR-29a和miR-92a的调控机制负责调控对功能性的MDSC的诱导。
2018年8月,Xiaofan Guo等人发现低氧诱导神经胶质瘤外泌体中的miR-10a和miR-21表达,而且这两种miRNA的表达通过靶向RORA和PTEN来介导神经胶质瘤外泌体诱导的MDSC增殖和激活。接受miR-10a或miR-21敲除神经胶质瘤细胞移植的小鼠要比那些接受正常的神经胶质瘤细胞移植的小鼠产生更少的MDSC。这些数据阐明了制神经胶质瘤细胞通过外泌体影响MDSC分化和激活的机制,并且证实了局部的神经胶质瘤低氧环境如何影响整个肿瘤免疫环境。
(5)外泌体与肿瘤信号轴
2018年12月,Dajiang Guo等人发现GTP酶RAB27A在一部分与较差的患者存活相关的黑色素瘤中过量表达。黑色素瘤细胞系中的RAB27A缺乏在体外能够抑制三维球状体浸润和细胞迁移,并且在体内能够抑制自发性的肿瘤转移。这种下降的浸润表型可被含有RAB27A的外泌体拯救,但不会被缺乏RAB27A的外泌体拯救,这表明RAB27A负责产生促进浸润的外泌体。再者,尽管RAB27A缺乏并不改变黑色素瘤细胞分泌的外泌体数量,但是会改变外泌体的大小和外泌体蛋白的组成和丰度,其中的一些蛋白已知调节癌细胞迁移。这些结果表明RAB27A是一种关键性的癌症调节因子,并且有可能是黑色素瘤中的一种预后标志物和治疗靶标。
2018年11月,David Novo等人报道表达突变型p53(mutp53)的肿瘤细胞通过增加RCP依赖性整合素在其他肿瘤细胞中的循环利用来产生介导mutp53的浸润/迁移功能在细胞间转移的外泌体。这个过程取决于mutp53控制sialomucin、podocalyxin和Rab35 GTP酶活性的能力,其中Rab35与podocalyxin相互作用来影响后者分选到外泌体上。来自表达mutp53的肿瘤细胞的外泌体也影响正常成纤维细胞中的整合素运输,从而促进高度浸润性的胞外基质沉积。这些结果表明mutp53以一种促进浸润性生长的方式影响远处器官中的微环境。
(6)外泌体与肿瘤耐药性
2018年12月,Ioanna Keklikoglou等人在乳腺癌模型中发现作为广泛两类用于外科手术前(新辅助)乳腺癌治疗的化疗药物,紫杉烷和蒽环类药物引发肿瘤释放具有增强的促转移能力的胞外囊泡(包括外泌体)。这些化疗药物引发的胞外囊泡富含蛋白ANXA6。作为一种钙离子依赖性蛋白,ANXA6促进NF-κB依赖性内皮细胞活化、Ccl2诱导表达和Ly6C+CCR2+单核细胞在肺转移前微环境中增殖,促进肺转移建立。让癌细胞中的Anxa6或宿主细胞中的Ccr2遗传失活都会减弱化疗药物引发的胞外囊泡的促转移效应。癌细胞中的Anxa6或宿主细胞中的Ccr2的遗传失活减弱了化疗诱发的EV的转移前效应。 ANXA6在接受新辅助化疗的乳腺癌患者的循环胞外囊泡中可检测到,并且潜在地在那里富集。
2018年11月,鉴于对化疗药物产生耐药性导致胰腺癌患者存在预后不良,Jia Fan等人发现由化疗耐药性PANC-1细胞分泌的外泌体(下称PANC-1外泌体)增加了MIA PaCa-2和BxPC-3细胞培养物对吉西他滨(GEM)的耐药性。相比于由化疗耐药性不那么强的胰腺癌细胞系MIA PaCa-2和BxPC-3分泌的外泌体,PANC-1外泌体过量表达EphA2。PANC-1细胞中的EphA2敲降抑制了它们将外泌体介导的化疗耐药性传递给MIA PaCa-2和BxPC-3的能力,而且用可溶性的EphA2处理MIA PaCa-2和BxPC-3细胞也不能促进化疗耐药性。这些研究结果表明膜结合的EphA2对EphA2介导的化疗耐药作用很重要。
基于以上的介绍可知,外泌体独特的生物学特性可能用于癌症诊断和治疗。这些特性有:特异性靶向,小尺寸,穿梭信号传导和生物分子,以及穿越生物屏障的能力等,然而,外泌体生物学局限性仍需进一步的深入研究来解决,以期将基于外泌体的技术研究尽快转化为临床应用。
-
科技前沿
-
技术原理

-
项目成果

-
项目成果

-
项目成果

















