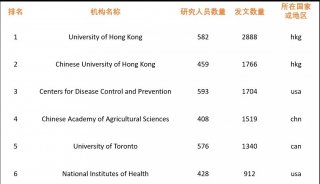
人冠状病毒HKU1进入机制研究
Nature子刊Nature Communications杂志在线刊出题为“Crystal structure of the receptor binding domain of the spike glycoprotein of human betacoronavirus HK-U1”的论文,病原生物学研究所钱朝晖副研究员课题组助理研究员欧秀元博士和崔胜研究员课题组关洪鑫博士为本文的并列第一作者,钱朝晖副研究员和崔胜研究员为本文并列通讯作者。
人冠状病毒HKU1在普通人群中的感染会导致感冒,在婴儿、老人和免疫缺陷的病人中的感染能导致肺炎。HKU1病毒跟小鼠肝炎病毒(Mouse hepatitis virus,MHV)和人冠状病毒OC43同属β冠状病毒属A型冠状病毒。前期,我们发现,不同于MHV和OC43, HKU1病毒S蛋白的受体结合区位于S1亚基的CTD(C-terminal domain)而不是传统的NTD(N-terminal domain)。在本研究中,钱朝晖课题组和崔胜课题组合作利用单波长异常衍射技术(Single-wavelength anomalous diffraction, SAD)解析了1.9埃分辨率的HKU1病毒的受体结合区(图1),发现其包含三个亚结构域:核心(Core)亚区,插入(Insertion)亚区和SD-1(subdomain-1)亚区。 核心亚区和SD-1亚区在不同冠状病毒中结构高度保守,而插入亚区高度变异。通过构建HKU1病毒不同亚型的S蛋白受体结合区的嵌合体,发现插入亚区是中和抗体的结合部位;通过进一步的点突变研究,发现了影响中和抗体结合的5个关键氨基酸;最后通过在人原代呼吸道上皮细胞中的竞争性感染实验,发现了影响S蛋白与其结合受体的2个关键氨基酸(图2)。另外,通过对MHV的SD-1上相关氨基酸的突变发现SD-1跟CTD的相互作用影响S蛋白的构象稳定,提出SD-1可能是将S蛋白跟受体结合引起构象改变的信号传导到S蛋白其它部分的关键节点。该研究成果将会为进一步研究冠状病毒的进入、免疫和进化机制打下良好基础。
本研究获得中国医学科学院医学与健康科技创新工程(2016-I2M-1-014)、国家自然科学基金和国家重点研究和发展计划的资助。特别感谢瑞士光源蛋白质晶体学线站(X06DA)王梅天教授团队提供的Native-SAD技术和测量机时的支持。
Abstract
Human coronavirus (CoV) HKU1 is a pathogen causing acute respiratory illnesses and so far little is known about its biology. HKU1 virus uses its S1 subunit C-terminal domain (CTD) and not the N-terminal domain like other lineage A β-CoVs to bind to its yet unknown human receptor. Here we present the crystal structure of HKU1 CTD at 1.9?? resolution. The structure consists of three subdomains: core, insertion and subdomain-1 (SD-1). While the structure of the core and SD-1 subdomains of HKU1 are highly similar to those of other β-CoVs, the insertion subdomain adopts a novel fold, which is largely invisible in the cryo-EM structure of the HKU1 S trimer. We identify five residues in the insertion subdomain that are critical for binding of neutralizing antibodies and two residues essential for receptor binding. Our study contributes to a better understanding of entry, immunity and evolution of CoV S proteins.