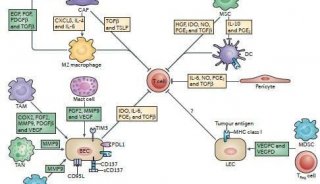
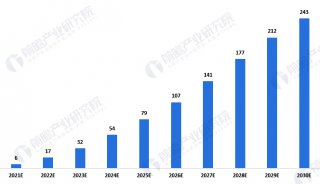
CAR-T细胞体内疫苗触发免疫系统参与,避免肿瘤逃逸
嵌合抗原受体T细胞疗法(CAR-T)已经在血液肿瘤中取得了喜人的成效,但是对实体瘤,却没有很好的治疗效果。
其中的原因之一就是,可供CAR-T识别的抗原不足。一方面肿瘤的高异质性使得并非所有的癌细胞都表达CAR靶向的抗原,另一方面,治疗过程中也会发生抗原丢失。
2023年7月5日,宾夕法尼亚大学马乐园及麻省理工学院Darrell J. Irvine共同通讯在Cell 在线发表题为“Vaccine-boosted CAR T crosstalk with host immunity to reject tumors with antigen heterogeneity”的研究论文,该研究者发现这还激活原有免疫系统的抗肿瘤免疫,大大增强了抗癌效果。能诱发抗原扩散(AS),激活原有免疫系统的抗肿瘤免疫,大大增强了抗癌效果。

研究中使用的“疫苗”是CAR配体与两亲性聚合物脂质尾部偶联+佐剂形成的,注射后配体可以结合白蛋白被转运至引流淋巴结(dLN),并被装饰到巨噬细胞和树突状细胞表面。随后这些细胞与CAR-T相遇,在共刺激受体信号和细胞因子的刺激作用下,增强了CAR-T的增殖和抗肿瘤免疫功能。
这个方法研究者们早在2019年就已经完成,当时他们就发现,不仅CAR-T细胞的抗肿瘤能力得到了增强,识别非CAR-T靶点的内源性T细胞活性也大大增加了。

疫苗增强型CAR-T作用原理
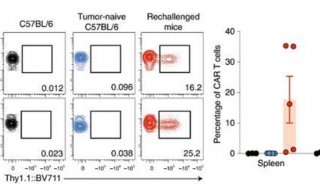
为了搞清楚其中的机制,研究者在EGFRvIII+CT-2A胶质母细胞瘤小鼠模型中测试了疫苗增强型CAR-T的效果,CAR-T靶向EGFR。在完成疫苗和CAR-T注射后,实验第21天分离小鼠脾细胞,与EGFRvIII-CT-2A细胞共培养,以此检测针对非CAR-T靶向的内源性T细胞反应。
从图中可以看出,CAR-T+疫苗的组合不知为何的确给原住民们大大打了一波儿气,可见显著的内源T细胞反应。
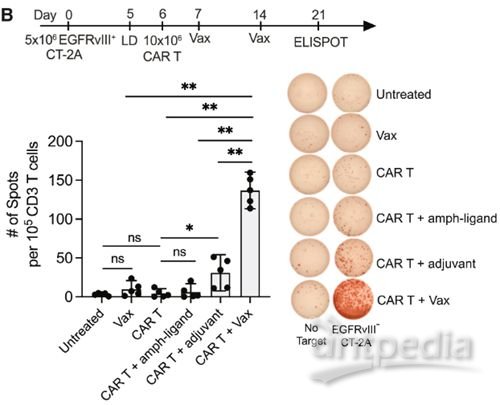
CAR-T+疫苗激活了内源T细胞的反应
在B16F10黑色素瘤小鼠模型中进行同样的实验也能观察到类似结果。显然,CAR-T+疫苗的组合诱发了抗原扩散(AS)。
研究者还分析了CAR-T+疫苗后内源性T细胞表型和功能的变化,发现肿瘤浸润淋巴细胞中CD8和CD4 T细胞显著增加,此外Treg比例略有降低。转录组分析获得的5个主要T细胞亚群比例变化可见下图。
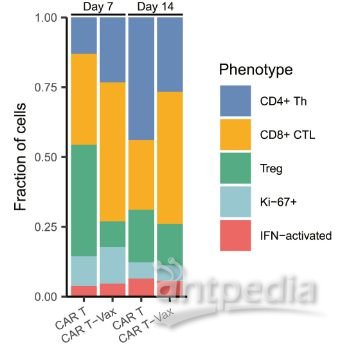
5个主要T细胞亚群变化
基因差异表达分析则发现,CAR-T+疫苗组的CD8 T细胞与细胞毒性和T细胞活化的转录本显著上调,IFN-γ、颗粒酶B、TNF-α表达增加。而CD4 T细胞中与Th1功能相关的转录本升高。
这说明,CART+疫苗能够增强肿瘤浸润CD8 T细胞的抗肿瘤能力,并促进CD4 T细胞向Th1表型分化。
研究者继续分析了CAR-T+疫苗带来的AS对复发的影响。
在携带mEGFRvIII+CT-2A的RAG1−/−免疫缺陷小鼠中,虽然CAR-T+疫苗起初也能带来很好的治疗效果,但是大多数动物在治疗后20-50天复发。分析复发肿瘤可以发现,EGFR表达的缺失或下调是主要的免疫逃逸机制。
相较野生型,免疫缺陷小鼠治疗后更易复发
研究者们也尝试用CAR-T+疫苗来治疗具有异质性的肿瘤。
将EGFRvIII+CT-2A和EGFRvIII-CT-2A细胞按照不同比例混合移植给小鼠,当100%细胞表达EGFRvIII时,小鼠能响应CAR-T+疫苗治疗并表现出长期缓解;当EGFRvIII-CT-2A细胞比例达到20%,仍有50%的小鼠能够实现完全缓解。


不同比例的混合肿瘤治疗效果
进一步分析发现,CAR-T细胞产生的IFN-γ对于诱导AS至关重要。IFN-γ在促进CAR-T细胞毒性杀伤的同时,也促进了树突状细胞的募集和抗原摄取,使其分泌IL-12,IL-12又能反过来增强T细胞的IFN-γ表达和细胞毒性活性。
总而言之,抗原异质性和抗原丢失是CAR-T疗法中肿瘤免疫逃逸和耐药的关键机制,这篇论文提出的疫苗增强型CAR-T则通过抗原扩散提出了新的解决办法,这为设计新的CAR-T临床试验提供了方向。