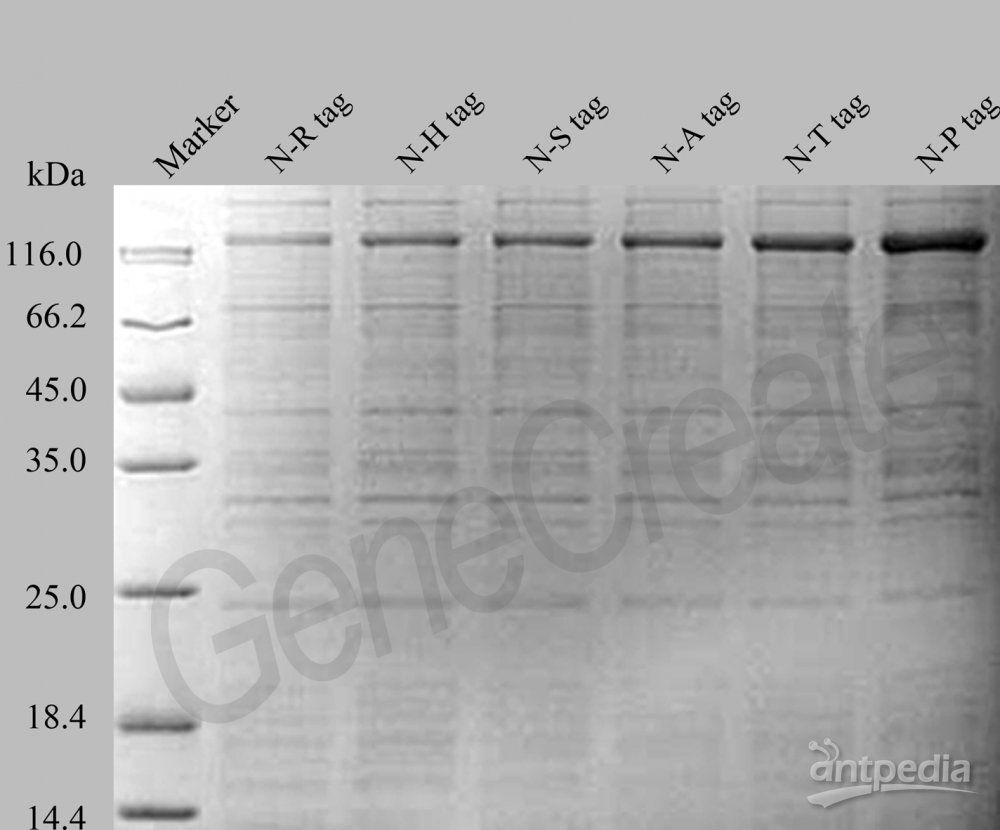
原核蛋白表达常见问题
蛋白不表达或表达量很低?
1、选择正确的表达载体与表达菌株
• T7启动子的载体(如pET系列载体)应选用BL21(DE3),BL21(DE3) pLysS,Transetta(DE3) 等菌株。非T7启动子的表达载体 (如Tac启动子的pGEX、pMAL系列表达载体) 应选用BL21表达菌株。
• 对细胞有毒性的蛋白,建议选用背景表达低、严谨调控诱导的菌株,如BL21(DE3) pLysS菌株。
• 对于带有稀有密码子的蛋白或来源于真核基因的蛋白,建议选用Transetta(DE3) 等菌株。
2、尝试不同的表达载体与菌株
不同的蛋白,对不同载体与菌株的偏好不同,如果某一蛋白无法通过优化诱导表达条件得到明显改善,可以更换其它菌株或表达载体。
3、表达条件的优化
• 选择不同的培养基。对于某些蛋白,在培养基中加入适量的葡萄糖(0.1%-0.5%),可以明显提高表达量。
• 较高的温度、较高的诱导物浓度、较长的表达时间,一般可以加快表达的速度,促进目的蛋白的积累,从而提高表达量。但可能会降低可溶蛋白的表达量,形成包涵体。
• 细胞的生长状态对蛋白表达有很大的影响,可以通过测量菌液的OD600值监测生长状态。对于大部分蛋白,应在菌株的对数生长期(OD600=0.5) 进行诱导。
目的蛋白不可溶,形成包涵体?
首先确认目的蛋白是否有表达。
• 裂解菌体并离心后,通过对全菌、上清、沉淀的检测,确认目的蛋白是否表达,是否形成了包涵体。
• 包涵体的形成与蛋白自身结构、表达系统、诱导表达条件等因素有着密切关系。在无法改变蛋白自身结构的情况下,可以尝试不同的表达载体与菌株,增强其溶解能力,优化出适合特定蛋白的表达系统。
• 目前认为包涵体的形成是由于蛋白在细胞内积累速度过快,没有正确折叠而聚集沉淀。可以通过优化诱导表达条件,如降低诱导温度、降低诱导物浓度、缩短表达时间、降低诱导时菌液的OD值等,以减缓蛋白的积累。
目的蛋白大小不正确?
• 蛋白的结构对判断分子量大小有一定影响。可以通过加热变性蛋白,从而准确判断蛋白分子量大小。
• 确认蛋白表达是否完整,蛋白是否提前终止表达。
• 若形成二聚体甚至多聚体,可以通过加热变性蛋白、打开二硫键 (加入DTT、β-ME等还原剂) 等手段,破坏次级结构,准确判断分子量大小。
-
仪器推荐

-
仪器推荐
-
仪器推荐
-
仪器推荐
 询底价 Tel:400-6699-117 转 5085
询底价 Tel:400-6699-117 转 5085 -
仪器推荐
-
焦点事件