科学家在PD-1阻断型抗体药物在肿瘤免疫治疗中取得进展
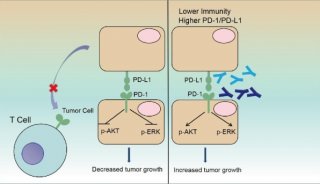
近年来,PD-1/PD-L1阻断型抗体药物在肿瘤免疫治疗中取得了进展,目前已经批准了多个抗体药物在黑色素瘤、非小细胞肺癌及霍奇金淋巴瘤等多种适应症中的临床应用。中国科学院微生物研究所研究员严景华和高福团队多次合作,解析了全球上市的第一个PD-1抗体药物nivolumab(Opdivo)及PD-L1抗体药物avelumab (Bavencio) 和 durvalumab (Imfinzi)的作用机制(Nature Communications 2017、Cell Research 2017和Protein Cell 2018)。近日,两个团队再次合作对团队筛选的多个PD-1单抗结合表位及功能进行了系统评价,同时对中国第一个获批上市的PD-1单抗toripalimab(拓益)的作用机制进行了研究,成果分别发表在iScience 和mAbs 杂志。
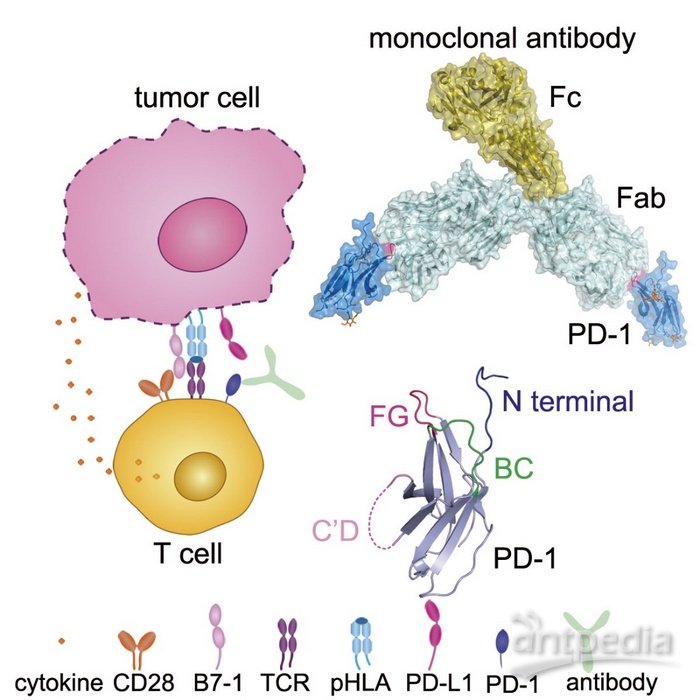
研究团队筛选到了两株能够特异性活化T细胞的PD-1抗体GY-5和GY-14。进一步通过NCG免疫缺陷鼠肿瘤模型,评价了GY-5和GY-14的肿瘤抑制活性,并完成了人源化改造,获得了人源化的单克隆抗体。通过结构生物学手段,团队进一步解析了toripalimab、GY-5和GY-14与PD-1的复合物结构,并对PD-1的糖基化修饰是否影响其与这些抗体的结合进行了评价。Toripalimab是君实生物开发的PD-1抗体,目前已经被批准用于黑色素瘤的临床治疗。通过结构分析,发现这三个抗体主要结合在PD-1的FG loop区,而这个FG loop对于PD-1/PD-L1的结合也具有重要贡献。FG loop在结合不同抗体时呈现显著的构象差异。结合之前该团队及其他团队报道的另外两个已上市的PD-1抗体nivolumab和pembrolizumab主要结合N端loop和C’D loop,因此,这三个抗体结合的FG loop是PD-1治疗性抗体的一个新位点,对于开发新的PD-1/PD-L1抑制剂,尤其是小分子抑制剂提供了重要的基础。
PD-1分子是一个高度糖基化的蛋白,在该研究解析的PD-1与抗体的复合物结构中,能够看到N49, N58, N116位点的糖基化修饰,而N58位点的糖基化修饰靠近其与这三个抗体的结合面。因此,该研究进一步对不同表达系统制备的PD-1蛋白与这三个抗体的亲和力进行了检测,以评价糖基化修饰是否会影响抗体的结合。结果表明,HEK-293T细胞表达的PD-1蛋白(完全糖基化)和大肠杆菌表达后体外复性获得的PD-1蛋白(完全无糖基化)与这三个抗体的亲和力无显著差异,这表明这三个抗体与PD-1的结合并不受糖基化修饰的影响。
综上所述,不同的PD-1抗体药物尽管都具有阻断PD-1与PD-L1的相互作用的功能,但是不同的抗体结合表位有明显差异,这可能暗示已经上市或准备上市的PD-1抗体药物可能具有各自独特的特征。因此,结构和功能的解析将为开发新一代抑制剂提供重要参考。
-
焦点事件

-
科技前沿

-
焦点事件

-
科技前沿