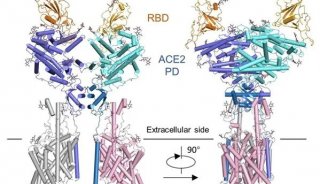
ACE2的主要功能以及在新型冠状病毒中作用
2019年12月以来,武汉新型冠状病毒感染引起的肺炎传播迅速,疫情紧急,基础研究也一直在推进中。中科院巴斯德所郝沛等学者及武汉病毒研究所石正丽团队研究发现新型冠状病毒的受体蛋白为血管紧张素转化酶2(ACE2)。在这项研究基础上,上海同济大学医学院研究团队连日利用高通量单细胞测序分析技术,研究了共计四万三千多个肺部细胞,进一步发现80%ACE2受体主要在II型肺泡聚集。表达ACE2的II型肺泡占其总数量的1.4%。在其他细胞类型如I型肺泡、支气管上皮细胞、成纤维细胞、内皮细胞和巨噬细胞中零星可见。而且通过对基因功能的分析,研究者还发现,这1.4%的ACE2+ II型肺泡细胞还表达至少20多个与病毒组装复制相关的功能基因。
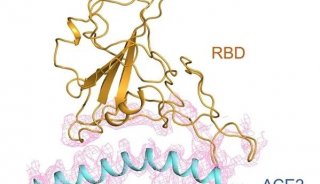
然而抗体研发所需的关键信息和结合表位,尚未被揭示。同济大学曹志伟教授团队与上海市公共卫生临床中心合作,研究表明,S蛋白是冠状病毒与宿主细胞表面ACE2受体结合、进而介导病毒入侵宿主细胞的关键蛋白,是抗体研发的重要靶点。因此,针对该表位区域研发抗体,空间位阻效应可能阻断病毒与ACE2受体的结合,有望起到病毒感染保护作用。同时,针对该表位区域,对2019新型冠状病毒抗体研发提供了重要的研发思路。
上述研究成果只是最近研究中的一部分,相信在医护和科学家的努力,一定可以战胜此次疫病。
综上所述,我们知道武汉新型冠状病毒的受体蛋白为血管紧张素转化酶2(ACE2),在这个阶段了解ACE2就显得至关重要了,现在就让小编给大家做一个基本介绍吧~
概述
血管紧张素转换酶(ACE) 2是羧肽酶ACE的同源物,羧肽酶生成血管紧张素II,这是肾素-血管紧张素系统(RAS)的主要活性肽。在2000年克隆ACE2之后,迄今为止已经描述了三种主要的ACE2功能。
ACE2是RAS的一个强力负调节因子,可平衡ACE的多种功能。通过靶向血管紧张素II,ACE2在心血管系统和许多其他器官中显示出保护作用。
ACE2被鉴定为引起SARS冠状病毒也是此次武汉新冠状病毒的主要结合受体,在SARS中ACE2的下调在病毒感染后严重肺衰竭的发病机制中起着重要作用。
ACE2及其同源物Collectrin均可与氨基酸转运蛋白结合,并在肾脏和肠道对氨基酸的吸收中发挥重要作用。
ACE家族分子
ACE最初在1956年被分离出来时被称为“高血压转化酶(hypertensin-converting enzyme)”。人类ACE基因位于17号染色体上,编码一种180kDa蛋白,具有两个同源结构域。每个结构域都有一个活跃的锌结合基序,His-Glu-X-X-His(HEXH基序),这种基序存在于许多肽酶中。ACE是一种I型跨膜糖蛋白,N端在胞膜外,通过单次跨膜锚定在细胞表面,C端在细胞膜内。
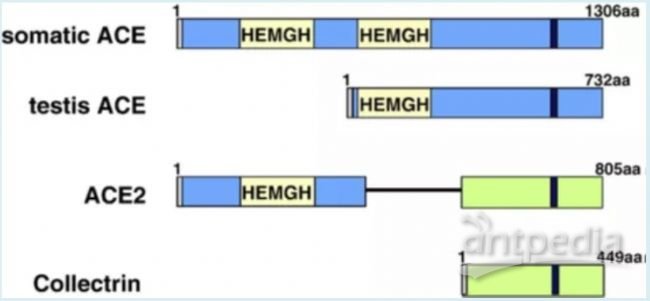
ACE2由805个氨基酸组成,是具有单一胞外催化结构域的I型跨膜糖蛋白。人类ACE2基因已经被克隆并被定位到X染色体上。像ACE一样,ACE2有两个结构域:氨基末端催化结构域和羧基末端结构域。催化结构域有一个活性位点--锌金属肽酶结构域--并且与ACE的氨基结构域显示出41.8%的序列一致性。ACE2的羧基末端结构域与Collectrin有48%的序列一致性,Collectrin是一种非催化蛋白,最近被证明在肾脏的氨基酸再吸收、胰腺β细胞增殖,以及可能胰岛素胞吐等方面具有关键作用。
ACE2功能
早期研究观察到ACE2主要在心脏、肾脏和睾丸中定位,在其他多种组织中低水平表达,尤其是结肠和肺,而后来的研究也表明ACE2在肝脏和肠等其他器官中也具有重要作用。ACE2通常定位于上皮细胞的腔面,这与ACE相反,ACE似乎均匀分布在极化细胞的顶膜和基底外侧膜之间。而当SARS冠状病毒通过表达ACE2的细胞腔面进行感染时,其感染效力提高10倍。
ACE和ACE2都属于金属蛋白酶的M2家族,其活性位点域暴露于细胞外表面,促进循环肽的代谢。ACE和ACE2都通过利用锌催化反应,锌与活性位点内保守的组氨酸配位,促进水分子对底物羰基键的亲核攻击,形成非共价结合的中间体。

ACE2在肾素-血管紧张素系统中的作用示意图
血管紧张素I(Ang I; DRVYIHPFHL)充当ACE(一种二肽基羧肽酶)的底物,并被转化为血管紧张素II(Ang II; DRVYIHPF),这是经典RAS的主要活性肽。 ACE2催化并灭活血管紧张素II,并产生血管扩张肽血管紧张素1-7(Ang 1-7; DRVYIHPF),该肽与Mas受体结合和/或降解为非活性肽。 红色箭头指示ACE裂解位点; 蓝色箭头显示ACE2裂解位点。应当指出,ACE2是一种非特异性蛋白酶,可以裂解多种其他底物,例如Apelin。
尽管有相似之处,ACE和ACE2的功能不同;ACE从其底物(二肽基肽酶,DPP)中释放一个碳端二肽,而ACE2则切割一个氨基酸(单羧肽酶)。ACE2催化可在脯氨酸和疏水或碱性碳末端残基之间优先水解的底物的肽。
各种ACE抑制剂,如卡托普利和赖诺普利不影响ACE2的活性,而ACE2活性可被二肽Pro-Phe抑制,并且据此已经开发了特定的ACE2抑制剂,例如肽类似物DX600和MLN 4760 ((S,S)-2-[1-羧基-2-[3- (3,5-二氯苄基)-3H-咪唑4-基]-乙胺基]-4-甲基戊酸)。ACE2对ACE的反调节轴促使研究人员考虑ACE2对动物模型心血管疾病的可能影响。通过基因治疗或重组蛋白进行ACE2治疗确实改善了高血压、动脉粥样硬化和肾脏疾病。基于电子构象的药物筛选确定了两种ACE2激活剂化合物(xanthenone和resorcinolnaphthalein),均可中度增强ACE2活性。然而,尚不清楚这些化合物的特异性。
ACE2被鉴定为致病病原体非典冠状病毒的功能受体。表达ACE2非催化活性突变体的细胞仍然允许非典病毒感染,这表明ACE2的肽酶作用对于非典病毒进入宿主细胞不是必需的。与生物学结果相一致,结构分析表明,非典冠状病毒Spike蛋白接触ACE2催化结构域的亚结构域I的顶端,但不影响亚结构域II,也不封闭肽酶活性位点。当非典型肺炎冠状病毒与ACE2连接时,ACE2的外结构域被裂解,而跨膜结构域被内在化,使病毒颗粒-宿主细胞进一步融合。因此,尽管详细的机制仍不清楚,但ACE2的跨膜区与非典冠状病毒-受体复合物在非典冠状病毒感染中从细胞膜到细胞质的转运有关。

ACE2与B0AT1氨基酸转运蛋白的相互作用
ACE2与B0AT1氨基酸转运蛋白(SLC6A19)相互作用,这是肠道上皮细胞中该转运蛋白的极化表面表达所必需的。 尚不清楚ACE2的切割是否有助于为B0AT1提供中性氨基酸。
Collectrin与ACE2的碳末端有47.8%的同一性;然而,与ACE2不同,Collectrin缺乏活性羧肽酶催化结构域。通过对小鼠的基因定位研究,偶然发现Collectrin是中性氨基酸转运蛋白的重要调节因子。Collectrin敲除小鼠的尿液中出现过量的中性氨基酸(酪氨酸和苯丙氨酸)。生化研究表明,Collectrin与B0AT1中性氨基酸转运蛋白结合,并对这些转运蛋白在肾近端小管氨基酸再吸收所需的细胞表面的正确表达起关键作用。尽管结构相似,ACE2并不与肾脏中的氨基酸转运蛋白结合,而是与肠道中的氨基酸转运蛋白结合,在肠道中ACE2高度表达,氨基酸被吸收。而ACE2的这一功能与其肽酶活性无关,其肽酶活性不是与氨基酸转运蛋白配对所必需。

参考文献:
http://engine.scichina.com/publisher/scp/journal/SCLS/doi/10.1007/s11427-020-1637-5?slug=figAndTable
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)30183-5/fulltext
https://www.sciencedirect.com/science/article/abs/pii/S0163725810001415?via%3Dihub