λ噬菌体的局限性λ噬菌体
实验方法原理
本实验以含原λ噬菌体和缺陷噬菌体λdg的双重溶原菌gal+作为供体,经紫外线诱导后,获取能转导半乳糖发酵基因的高频转导噬菌体裂解液,然后让这些转导噬菌体将gal+基因转移到受体菌gal-中去。
实验材料 供体菌 : Escherichia coli K12 F2 gal + (带有原噬菌体λ和缺陷噬菌体λdg)受体菌 : E . coli K12 S gal -
试剂、试剂盒 LB液2×LB液YT液体培养基YT半固体培养基YT固体培养基9皿EMB-gal培养基11皿pH7.0的磷酸缓冲液生理盐水氯仿
仪器、耗材 台式离心机 恒温水浴锅 小试管 大试管 移液管 培养皿 紫外辐射装置
实验步骤
(一)噬菌体裂解液的制备
1.将供体菌接入5mlLB培养液中,37℃振荡培养过夜。
2.取0.5ml过夜培养物转入另一支5mlLB培养液试管中(剩余的菌液置冰箱保存,备用),37℃继续培养4~6h。
3.将培养物转入10ml无菌离心管中,4℃3000r/min离心10min。
4.去上清液,加1ml的磷酸缓冲液(0.1mol/L,pH7.0),振荡悬浮,再加入4ml同样的缓冲液制成菌悬液。
5.取2ml菌悬液于无菌培养皿(Φ6cm)中。在红光下将含有菌悬液的培养皿置紫外灯(15W)40cm处,打开培养皿盖照射10s(边照射边搅拌),然后加入2×LB液2ml,混匀后置37℃避光培养2~3h。
6.将上述暗培养液转入无菌大试管中,加入5~8滴氯仿,剧烈振荡30s,室温静置5min后转入另一支无菌离心管,再经4℃,3000r/min离心10min。
7.小心将上清液吸取转入另一无菌试管中,上清液即为λ噬菌体裂解液。裂解液中加入一滴氯仿,混匀后置4℃保存,备用。
(二)噬菌体效价的测定
1.将受体菌接入5ml培养液(补加麦芽糖和MgSO4),置37℃振荡培养过夜。
2.取0.5ml过夜培养物于另一支5mlYT培养液(同样加麦芽糖和MgSO4)试管中(其余的受体菌液置4℃保存,备用),37℃继续振荡培养3~4h。
3.将噬菌体裂解液用YT培养液稀释至10-7,分别取10-5、10-6、10-7稀释液0.1ml于无菌试管中,再加入0.1ml受体菌液,混匀后置37℃保温15~20min,然后倒入4.5ml半固体YT培养基(培养基温度约为45℃),混匀后,迅速倒入底层YT培养基的平板中。按此操作每稀释度制3皿,待凝固后置37℃培养过夜。
4.观察出现的噬菌斑,计算裂解液中噬菌体的效价。
(三)转导试验
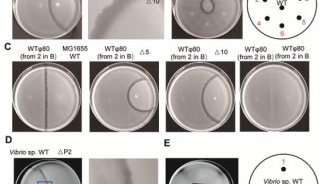
1. 取EMB-gal平板二皿,在平板底部按图27-1画上标记。
2. 取保存的受体菌液少许涂成一条带,再取保存的供体菌液少许在另一区域涂一条带。待干后在两个圆圈和两个方格内各滴一小滴噬菌体裂解液(先滴两圆圈内,后滴方格内),置37℃培养48h。
3. 观察平板上形成的噬菌体,统计噬菌斑形成单位数(PFUs),并计算λ噬菌体裂解液的效价。
4. 图示转导试验结果,确定是否出现转导现象。
注意事项
1.配制半固体培养基时,使用琼脂粉为宜。琼脂的浓度为0.45%~0.5%。
2.噬菌体裂解液与受体菌液混合保温期间切勿摇动试管,以免影响噬菌体的吸附,使其效价偏低。
其他
实验试剂:
LB 液 ( 5ml/ 试 管 2 支 ; 4. 5ml/ 100ml 三角 瓶 1 瓶 ) , 2× LB 液 ( 2ml/ 小 试 管 1 支 ) ,YT 液体培养基 ( 4. 5ml/ 试管 1 支 ; 4. 5ml/ 试管 7 支 ; 4 .5ml/ 100ml 三角瓶 1 瓶 ) , YT 半固体培养基 (4 .5ml/ 试管 9 支) , YT 固体培养基 9 皿 ( 本实验中 YT 培养基均补加麦芽糖和 MgSO4 , 终浓度分别为 1 % 和 10mmol/ L) , EMB-gal 培养基 11 皿 , 0 .1mol/ L pH7. 0 的磷酸缓冲液 ( 4ml/ 试管 1 支 ) , 生理盐水 (4 .5ml/ 试管 3 支 ) , 氯仿。
-
项目成果