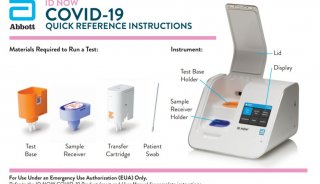
后新冠时代,FDA将如何对新冠检测试剂进行监管?
虽然COVID-19的感染仍然广泛存在,但有迹象表明,该疾病的大流行阶段正在接近尾声,随着它的结束,许多人预计FDA将结束紧急使用授权(EUA)的发放,大多数临床实验室和测试供应商一直在据此操作。
一些诊断公司已经采取行动,通过标准的从头开始或510(k)监管途径进行其COVID-19测试,但许多公司正在等待,因为他们继续评估其测试的潜在市场,并期待着FDA的进一步指导。
去年12月,FDA发布了一份指南草案,为COVID-19测试从EUA过渡到从头开始或510(k)审批制定了计划。根据该指南(目前仍是草案),终止相关EUA的通知将在终止日期前180天在联邦公报上公布。希望在EUA结束后继续营销其测试的公司必须在EUA终止日期前提交并被FDA接受营销申请(根据特定测试是否存在已获批准的前提设备而定的de novo或510(k))。
一旦提交的材料被接受,供应商可以在EUA终止日期后继续销售测试,同时FDA对提交的材料进行评估,只要他们更新他们的产品标签,说明该测试是根据EUA授权的,并且正在接受FDA审查。
考虑到这一拟议的过渡计划,似乎没有什么动力让公司在EUA终止通知公布前提交材料。一些公司,包括提供COVID-19测试的雅培公司和家庭测试供应商Ellume公司,拒绝对他们在EUA结束后的测试营销计划发表评论。
同时,与雅培一样提供抗原和分子COVID-19测试的西门子健康公司在一份声明中说,它“致力于提供临床医生所需的COVID相关测试,因为我们正在从大流行阶段转向流行阶段”。
该公司补充说:“随着这个动态市场的不断发展和监管条件的变化,我们正在对需求进行实时评估。我们期望在EUA期满后能够提供所需的测试,并将根据需要寻求适当的监管途径。”
曾担任FDA负责执法的副总法律顾问的Hyman,Phelps & McNamara律师事务所的主任Jeff Gibbs建议,许多公司可能仍在评估在EUA发行结束后,他们希望将哪些测试推向市场。
他说:“我会考虑我想拥有的商业产品是什么?我不知道。如果我有多种‘COVID-19测试’,我是否想把所有的东西都通过510(k)。什么会是最有吸引力的?”
例如,Gibbs说,公司可能会决定,在未来几年,许多COVID-19测试将作为同时测试多种呼吸道病毒检测组合的一部分来完成,因此将优先考虑将这些检测从EUA过渡到510(k)。
事实上,许多公司已经自愿停止销售和分发他们从FDA获得EUA的COVID-19测试,并要求该机构撤销授权。至少在某些情况下,这些测试没有找到市场的吸引力。在其他情况下,一家公司选择‘过渡’到使用该公司的另一种COVID-19测试。
企业可能在等待更多的信息或FDA的最终指导意见,然后再继续寻求COVID-19测试的全面监管批准。
“除非你知道FDA想要什么,否则很难做具体的事情。”
他举例说,供应商可能有的一个问题是,FDA将如何权衡现实世界的证据,这些证据是在大流行病的过程中在临床试验之外收集到的。
在一封电子邮件中,FDA的一位官员说,该机构“愿意考虑支持监管文件的现有现实世界证据”。
该官员补充说:“如果测试开发者拥有可用于确定其测试性能的现实世界证据,我们建议他们进行讨论,以适当利用现实世界的使用和经验作为其营销申请的一部分。”
医疗器械贸易协会AdvaMed在3月23日的一封信中对FDA的指南草案提出了一些建议,包括该机构“考虑为某些高容量的EUA设备开发一个标准信息和数据预期模板”,它指出这可以减轻和加快该机构的审查过程。
FDA已经为两项COVID-19测试颁发了重新授权或510(k),即生物梅里埃的BioFire Respiratory Panel 2.1(2021年3月17日重新授权)和其BioFire COVID-19 Test 2(2021年11月1日510(k))。
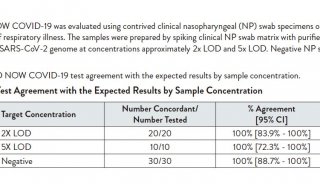
这些测试的决定摘要提供了该机构在未来的COVID-19 510(k)申请中所寻找的证据。为了支持其提交的BioFire COVID-19 Test 2,生物梅里埃在三个研究地点收集了534份标本,其中COVID-19的流行率从8%到16%不等。与对比设备BioFire Respiratory Panel 2.1相比,该测试的灵敏度为98.6%,特异性为99.6%。
其他公司已经提交了新的申请,包括Chembio诊断公司在2021年12月提交的DPP SARS-CoV-2抗原测试,以及Cue Health公司本月提交的Cue COVID-19测试家用分子测定,但FDA还没有对这些申请做出裁决。
虽然很少有测试厂商希望在这一过程中取得先机,但Cue Health公司CEO Ayub Khattak说,作为一家以家庭市场为目标的公司,他的公司认为在测试性能有时是一个问题的领域,从头授权是一种竞争优势。
他说:“我认为COVID的特点之一是人们不知道该相信什么信息,而且对于每种测试的质量是什么,一直有很多困惑。当有一个被批准的测试时,这种困惑可以得到澄清,因为在那个时候,它意味着它符合FDA对实际授权产品的严格标准,而不是在紧急情况下授权的产品。”
美国临床实验室协会(ACLA)在3月1日对FDA指南草案的评论信中提出的另一个问题是,该机构将如何对待在EUA终止后开发的COVID-19的实验室测试。在信中,ACLA要求FDA“承认[其]长期以来对LDTs行使的执法自由裁量权,并明确说明这种COVID-19的LDTs在相关的EUA声明终止后将不需要任何FDA授权”。
FDA官员拒绝对这个问题发表评论。根据COVID-19 EUA的结束时间,这个问题可能会受到国会对确认准确、领先的IVCT开发(VALID)法案的影响,该法案将解决围绕FDA监管LDT的权力的长期问题,将它们置于该机构的权力之下。
一些观察家认为,该法案可能在今年通过,可能作为重新授权医疗器械用户费修正案的更大方案的一部分。
COVID-19的EUA期何时结束仍不清楚。寨卡病毒和埃博拉病毒的EUA在上个十年中期开始,目前仍在进行。不过,吉布斯表示,鉴于COVID-19的EUA对国家医疗系统的影响如此广泛,以及该病毒已成为一个政治问题,它可能会尽早结束。
然而,与此同时,COVID-19测试的EUA申请继续涌入。在FDA于4月20日为COVID-19测试开发者举行的全体会议上,该机构体外诊断和放射健康办公室主任Timothy Stenzel说,它仍然看到每月约130份申请。
-
焦点事件

-
焦点事件

-
焦点事件
-
焦点事件

-
焦点事件