仪器分析的分类
一般的说,仪器分析是指采用比较复杂或特殊的仪器设备,通过测量物质的某些物理或物理化学性质的参数及其变化来获取物质的化学组成、成分含量及化学结构等信息的一类方法。
这些方法一般都有独立的方法原理及理论基础。
光分析法
光谱法和非光谱法
非光谱法是指那些不以光的波长为 特征的信号,仅通过测量电磁幅射的某些基本性质(反射,折射,干射,衍射,偏振等)。
光谱法则是以光的吸收,发射和拉曼散射等作用而建立的光谱方法。这类方法比较多,是主要的光分析方法。
2. 电分析化学方法
以电讯号作为计量关系的一类方法, 主要有五大类:
电导、 电位、 电解、 库仑及伏安。
3. 色谱法
是一类分离分析方法, 主要有气相色谱和液相色谱。
4. 其它仪器分析方法
① 质谱, ② 热分析,③ 放射分析
一.原子光谱的产生
原子的核外电子一般处在基态运动,当获取足够的能量后,就会从基态跃迁到激发态,处于激发态不稳定(寿命小于10-8 s),迅速回到基态时,就要释放出多余的能量,若此能量以光的形式出显,既得到发射光谱。
激发电位:
从低能级到高能级需 要的能量.
共振线:
具有最低激发电位的谱线.
原子线(Ⅰ) 离子线(Ⅱ,Ⅲ) 相似谱线
Ni = N0 gi/g0 e-Ei/kT (2) (玻兹曼方程)
gi,g0 为激发态和基态的统计权,Ei为激发电位,K为Boltzmann常数,T为温度。
2)代入(1)得:
Iij = gi/g0AijhυijN0e-Ei/kT
此式为谱线强度公式。
Iij 正比于基态原子N0 ,也就是说 Iij ∝C,这就是定量分析依据。影响Iij的因素很多,分别讨论如下:
1.光谱项
原子光谱是由原子外层的价电子在两能级间跃迁而产生的,原子的能级通常用光谱项符号来表示:
n2S+1LJ or n M LJ
n为主量子数;L为总量子数;S为总自旋量子数;J为内量子数。M=2S+1,称为谱线的多重性。J又称光谱支项。
跃迁遵循选择定则:
1.主量子数n变化,Δn为整数,包括0。
2.总角量子数L的变化,ΔL=±1。
3.内量子数J变化,ΔJ=0,±1。但当J=0时, ΔJ=0的跃迁是禁戒的。
4.总自旋量子数S的变化,ΔS=0,即单重项只跃迁到单重项,三重项只跃迁到三重项。
2.自蚀
在谱线上,常用r表示自吸,R表示自蚀。
在共振线上,自吸严重时谱线变宽, 称为共振变宽
击穿电压:使电极间击穿而发生自持放 电的最小电压。
自持放电:电极间的气体被击穿后,即使没有外界的电离作用,仍能继续保持电离,使放电持续。
燃烧电压:自持放电发生后,为了维持放电所必需的电压。
由激发态直接跃迁至基态所辐射的谱线称为共振线。由较低级的激发态(第一激发态)直接跃迁至基态的谱线称为第一共振线,一般也是元素的最灵敏线。当该元素在被测物质里降低到一定含量时,出现的最后一条谱线,这是最后线,也是最灵敏线。用来测量该元素的谱线称分析线。
⑵.分辩率
实际分辩率:指摄谱仪的每毫米感光板上所能分辩开的谱线的条数。或在感光板上恰能分辨出来的两条谱线的距离。
理论分辩率
R=λ/Δλ
注:λ为两谱线的平均值,Δλ为它们的差值。
b.平面光栅 Δ=d(sinφ+sinφ′) 当 Δ=±Kλ, 则 Kλ=d(sinφ+sinφ′) -----为光栅公式.
例:对一块宽度为50mm,刻线数为600条/mm的光栅,它的一级光栅的分辩能力为多少?
解:R=1×50×600=3×104
此时,在6000埃附近的两条谱线的距离为多少?
解:Δλ=λ/R =6000/3000=0.2 埃
当内标元素的含量一定时,C2为常数;又当内标线无自吸时,b2=1
此时, I2 = a2
分析线对的强度可表示为:
I1/I2 = a Cb
取对数后,得到 :
log R = log(I1/I2)
= b log C + log a
此为内标法定量分析的基本公式。
使用内标法必须具备下列条件:
分析线对应具有相同或相近的激发电位和电离电位。
2.内标元素与分析元素应具有相近的沸点,化学活性及相近的原子量。
3.内标元素的含量,应不随分析元素的含量变化而变化。
4.内标线及分析线自吸要小。
5.分析线和内标线附近的背景应尽量小。
6.分析线对的波长,强度及宽度也尽量接近。
原子吸收光谱法(AAS)
一. 基本原理:它是基于物质所产生的原子蒸气对特定谱线的吸收作用来进行定量分析的一种方法。
基态 第一激发态,又回到基态,发射出光谱线,称共振发射线。
同样从基态跃迂至第一激发态所产生的吸收谱线称为共振吸收线(简称为共振线)
锐线光源
空心阴极灯:即发射线半宽度远小于吸收线半宽度光源.
当用线光源时, 可用K0 代替 Kν ,用吸光度表示: A=lgI0/I=lg[1/exp(-K01)]=0.43K01
A= k·N·1
锐线光产生原理:在高压电场下,
阴极向正极高速飞溅放电, 与载气原子碰撞, 使之电离放出二次电子, 而使场内正离子和电子增加以维持电流。 载气离子在电场中大大加速,
获得足够的能量, 轰击阴极表面时, 可将被测元素原子从晶格中轰击出来, 即谓溅射, 溅射出的原子大量聚集在空心阴极内, 与其它粒子碰撞而被激发,
发射出相应元素的特征谱线-----共振谱线。
化学计量火焰 由于燃气与助燃气之比与化学计量反应关系相近,又称为中性火焰 ,这类火焰, 温度高、稳定、干扰小背景低,适合于许多元素的测定。
富燃火焰 指燃气大于化学元素计量的火焰。其特点是燃烧不完全,温度略低于化学火焰,具有还原性,适合于易形成难解离氧化物的元素测定;干扰较多,背景高。
贫燃火焰 指助燃气大于化学计量的火焰,它的温度较低,有较强的氧化性,有利于测定易解离,易电离元素,如碱金属。
光谱通带: W = D·S
被测元素共振吸收线与干扰线近,选用W要小,干扰线较远,可用大的W,一般单色器色散率一定,仅调狭缝确定W。
物理干扰: 是指试液与标准溶液物理性质有差别而产生的干扰。粘度、表面张力或溶液密度等变化,影响样品雾化和气溶胶到达火焰的传递等会引起的原子吸收强度的变化。非选择性干扰。消除方法:配制被测试样组成相近溶液,或用标准化加入法。浓度高可用稀释法
化学干扰: 化学干扰是指被测元原子与共存组分发生化学反应生成稳定的化合物,影响被测元素原子化。
电离干扰:在高温下原子会电离使基态原子数减少, 吸收下降, 称电离干扰. 消除的方法是加入过量消电离剂, 所谓的消电离剂, 是电离电位较低的元素, 加入时, 产生大量电子, 抑制被测元素电离.
光谱干扰:吸收线重叠待测元素分析线与共存元素的吸收线重叠
背景干扰:背景干扰也是光谱干扰,主要指分子吸与光散射造成光谱背景。分子吸收是指在原子化过程中生成的分子对辐射吸收,分子吸收是带光谱。光散射是指原子化过程中产生的微小的固体颗粒使光产生散射,造成透过光减小,吸收值增加。
背景干扰,一般使吸收值增加。产生正误差。
标准加入法: Ax = k C A0 = k(C0 + Cx) Cx = AxC0/(A0-Ax)
标准加入法能消除基体干扰,不能消背景干扰。使用时,注意要扣除背景干扰。
习惯灵敏度 现定义:特征浓度,是指产生1%吸收时,水溶液中某元素的浓度。通常用mg/ml/1%表示
-
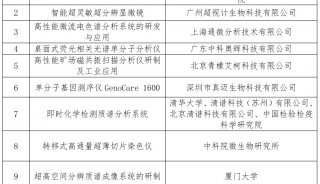
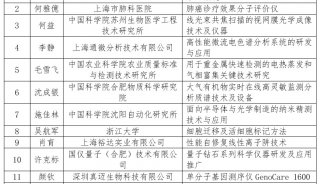
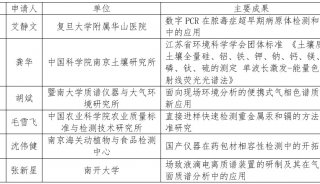
会议会展