蛋白质磷酸化的蛋白磷酸激酶的纯化与活性分析
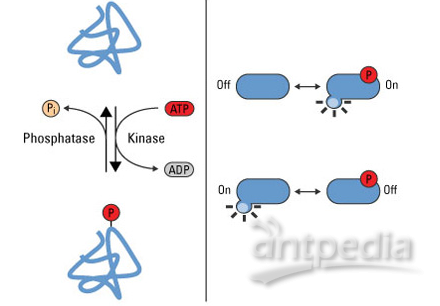
蛋白磷酸激酶是能催化磷酸基团从磷酸供体转移到受体蛋白的酶,通常ATP的γ位磷酸(或其它三磷酸核苷)为供体。国际生物化学联合会根据受体氨基酸的特异性,将蛋白激酶分为以下几类: ①以蛋白乙醇基作为受体的磷酸转移酶称为蛋白丝氨酸或苏氨酸激酶; ②以苯基为磷酸受体的磷酸转移酶称为蛋白酪氨酸激酶; ③以His,Arg或Lys为受体的磷酸转移酶称蛋白His激酶; ④以Cys残基作为受体的磷酸转移酶称蛋白Cys激酶; ⑤以乙酰基作为受体的磷酸转移酶称天冬或谷氨酰胺激酶。
前两类酶最常见,许多蛋白丝/苏氨酸或酪氨酸激酶已被纯化。利用分子生物学技术,已克隆出100多个蛋白激酶的基因。有些已通过测定其核苷酸序列而推出其相应的氨基酸序列。在很多情况下,克隆的酶基因产物氨基酸受体特异性不能被直接测定,一般是通过序列分析与已知特异性的蛋白激酶比较而得出。所有已知的丝/苏和酪氨酸蛋白激酶都有一个共同的催化结构域(约270个氨基酸),通过催化结构域的序列同源性比较,可将蛋白酪氨酸激酶家族分成若干亚家族。蛋白丝/苏氨酸激酶家族较酪氨酸激酶家族大。此外,还有许多有关His,Lys和Arg特异性磷酸化酶活性的报道,但这些酶未被纯化,其分子结构也不清楚。 (一)蛋白磷酸激酶的纯化
蛋白激酶的纯化分微量纯化和大量纯化两种,前者通常应用在特殊条件下培养的细胞,后者一般应用于特殊的组织器官。微量纯化的优点是克隆化的细胞株具有均一的细胞类型并处于同步的细胞周期,细胞内成分可被放射性同位素特异标记,在细胞培养时加特殊因素可研究细胞内某些感兴趣的途径。缺点是原料少,纯化出的蛋白量有限。 ,通常选用惰性系统,如Pharmacia的FPLC系统。该系统的优点是具有很大的内在惰性,并具有保持大分子生物活性的特点。该系统在一个单元内含有单一的硬件,可在冷室和室温操作。此外,可采用快速的梯度(40~45分钟)形式和较广适用范围的高效凝胶和柱系统。这是因为在此条件下多数蛋白质不与树脂结合,包括能使激酶失活的磷酸酶。然而,许多激酶尽管其表现等电点≤5.5,但在中性条件下仍可与MonoS结合,这可能是由于其磺酸基与ATP或底物分子结构有些类似。大体积抽提物可用泵直接进样,并进行连续两次的离子交换分离。FPLC预装的凝胶排阻柱可在30分钟内完成分离,较传统凝胶快得多。但由于柱填料粒度小,上样体积不超过200μl,样品量不超过5~10mg,纯化量较小有些性质难以鉴定,因而需多次纯化。Pharmacia引入一种新的介质(Sephacryl HR)较传统的超细胶流速快5倍,这些凝胶在很大程度上减小了凝胶过滤色谱的时间。在完成亲和纯化后,酶的纯度可用SDS-PAGE检测并定量测定其比活性。 (二)蛋白磷酸激酶的活性分析 蛋白激酶活性分析分为两步: ①末端标记的三磷酸核苷核供体(通常是ATP,有时用GTP)中的磷酸基团转移到蛋白质或肽底物上; ②将磷酸化的底物分离出并进行定量分析。 前者通常在溶液中进行,酶和底物均在液相中。后者为了去除游离的标记核苷酸,通常需要用三氯醋酸沉淀、SDS-PAGE分离或使标记底物结合于纤维素膜上。 有时可将酶或底物固定于固相载体上,如蛋白质混合物经SDS-PAGE后转移到硝酸纤维素膜上,然后封闭,放入含有酶和标记ATP的溶液中。或者更进一步,设计一个蛋白激酶分析系统(酶活性的原位分析),将蛋白激酶和它的底物均固定于硝酸纤维素膜上,这一方法可与标准的液相分析方法达到相等的灵敏度和线性范围。其分析原理是含有蛋白激酶活性的样品先固定于硝酸纤维素膜上(点滴或真空抽吸),然后将滤膜浸入合适的蛋白底物溶液中,底物蛋白质与剩余的膜结合位点结合,然后加入同位素标记的ATP,作用一定时间后洗去膜上未反应的ATP并终止反应,参入物经放射自显影或液闪计数定量,与膜结合的酶和底物均具有一定的运动性,两者反应的定量值代表磷酸化的程度。 以酪蛋白激酶Ⅱ的活性测定方法为例: 试剂:缓冲液A25mmol/L Tris,1mmol/L EDTA,100mmol/LNaCl,pH8.0 缓冲液B25mmol/L Tris,1mmol/LEDTA,200mmol/L NaCl,10%甘油 (V/V),1mmol/L DTT,pH8.0 酪蛋白激酶Ⅱ底物 水解或部分脱磷酸的酪蛋白10mg/ml溶解于缓冲液A中。 酪蛋白激酶Ⅱ反应混合物 25mmol/L Tris,pH8.5,100mmol/L NaCl,10mmol/LMgCl2,1mmol/L DTT,0.1μmol/L〔V-32P〕ATP(100Ci/mmol) 操作步骤:
1.剪一适当大小的硝酸纤维素膜并划成25px大小的方格; 2.用缓冲液A浸湿膜并放于一用同样缓冲液浸湿的滤纸上,使膜平坦; 3.用缓冲液B(含1mg/ml牛血清白蛋白)将样品稀释到合适的浓度,膜上每个点所加的样品其激酶活性在0.5~50pmol单位(1pmol单位代表每分钟转移1pmol 32P的酶量),当酶比活性在1μmol/min·mg-1时则每个点应加纯酶0.5~50ng; ,待液滴消失后将膜面对含有缓冲液A(包括1~10mg/ml的底物)的Parafilm封口膜(贴于玻璃平板上),在湿润环境中23℃作用30分钟。大片膜可密封于塑料袋中; 5.在100ml缓冲液A中洗膜并置于一新的Parafilm膜上(加有反应混合物溶液25 μl/cm2),23℃作用5~30分钟; 6.用缓冲液A 100ml洗膜4次,空气干燥后进行放射自显影。或切成方块进行液闪计数定量。
该方法在应用时最常见的问题是硝酸纤维素膜过载(指总蛋白或酶活力单位)。硝酸纤维素膜结合BSA的线性范围可达50μg/cm2(相当于每斑点5μg),而结合容量可达500μg/cm2,如果样品本身造成蛋白质超载,则应降低稀释液中的BSA浓度。同时应注意不要加过量的酶,因为超过50pM单位即超过了该方法的线性范围,并可能影响硝酸纤维素膜邻近斑点的检测。该方法用于其它蛋白激酶检测时应适当变换测定条件。因蛋白激酶活性的斑点印迹方法与标准的液相方法在灵敏度、检测范围、线性等方面相当,所以可以代替后者进行常规检测。也在天然凝胶电泳和转移电泳后分析蛋白激酶活性的分布,可用于分析酶在不同发育阶段各组织表达的变化、cDNA克隆分析和突变体分析。