苦杏仁中黄曲霉毒素B1,B2,G1,G2的液质联用检测分析
黄曲霉毒素(aflatoxins,简称AFs)是由黄曲霉、寄生曲霉等产生的有毒次生代谢产物,主要包括黄曲霉毒素B1(AFB1),B2(AFB2),G1(AFG1),G2(AFG2),具有严重的致癌、致畸、致突变等作用,危害巨大,其中AFB1在1993年被世界卫生组织癌症研究机构(IARC)划定为Ⅰ类致癌物[1-2]。对此,《中国药典》2010年版一部收录了桃仁、胖大海等五味中药中AFB1,AFB2,AFG1,AFG2的高效液相色谱荧光检测方法[3],并规定AFB1最高限量为5 μg·kg1,AF(B1+B2+G1+G2)最高限量为10 μg·kg1,但并未对苦杏仁等其他易霉变的药材制订相关的限量标准。
苦杏仁Semen Armeniacae Amarum为蔷薇科植物山杏、西伯利亚杏、东北杏或杏的干燥成熟种子,具有降气止咳平喘,润肠通便等功效[4]。与桃仁相似,苦杏仁富含淀粉、油脂类等成分,易因贮藏、处理等过程中的操作不当而引发霉变,进而污染真菌毒素。本课题组前期也发现苦杏仁极易发生霉变,且污染AFB1的几率远高于其他中药材[5-6]。因此,为了保障患者的健康,推动中国药典对苦杏仁进行相关限量标准的规定,有必要对其污染黄曲霉毒素的情况进行进一步的调查研究。
液质联用技术(LC-MS/MS)具有选择性高、灵敏度好、多组分同时检测等优点,近年来被广泛用于真菌毒素的研究,在中药真菌毒素检测方面显示了很好的应用前景[7-9]。由于中药成分复杂,产生的基质效应成为影响LC-MS/MS法检测准确度的主要因素,目前国内对中药材真菌毒素的LC-MS/MS检测多侧重于采用免疫亲和柱或多功能净化柱的方法进行样品纯化,但其纯化效果容易受样品基质、pH、溶剂、盐浓度等的影响,同时各种纯化柱的价格昂贵,无法重复使用,检测成本高[10],无法满足对大量药材进行筛查的需求。
本研究旨在采用稀释法,并通过优化色谱和质谱条件,从而达到减少基质效应影响的目的,建立一套不需经过复杂、昂贵的纯化步骤即可对苦杏仁污染的AFB1,B2,G1,G2同时进行定性定量检测的LC-MS/MS方法,实现其经济、快速、高通量的筛查,为进一步完善中药的安全性评估提供参考。
1 材料
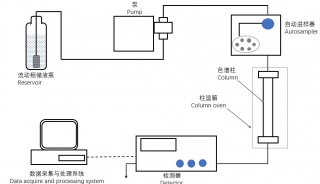
TSQ Quantum Access液相色谱-串联三重四级杆质谱仪,带Xcalibur 2.0操作软件(美国,Thermo);氮吹仪(美国,caliper);台式冷冻离心机(德国,Sartorius);VXR涡旋振荡器,带VX8配件(德国,IKA);pH计(美国,Thermo);1/1万电子分析天平(德国,Sartorius)。
黄曲霉毒素混合对照品溶液,含AFB1 1.039 mg·L-1,AFB2 0.314 0 mg·L-1,AFG1 1.056 mg·L-1,AFG2 0.288 0 mg·L-1(批号LB96951),购自美国SUPELCO公司。甲醇、乙腈(色谱纯,德国,Merck);醋酸铵、甲酸(色谱纯,美国,DikmaPure);真菌毒素多功能净化柱Mycosep226(美国,Romer);实验所用超纯水由Millipore Q纯净水设备(法国,Millipore)制得。
11份苦杏仁样品各100 g,分别购自广州地区的药店、药材市场和医院,经广州中医药大学中药资源科学与工程研究中心詹若挺研究员鉴定为正品,样品购买后置密封袋中独立包装,于真空干燥器中保存备用。
2 方法
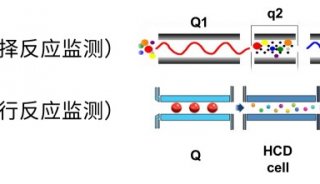
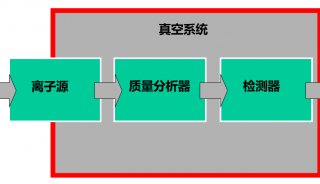
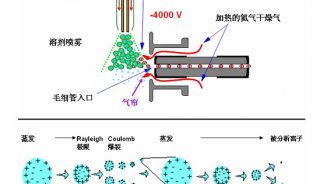
2.1 色谱条件 色谱柱为Hypersil GOLD C18柱(2.1 mm×100 mm,3 μm)(美国,Thermo);流动相A-甲醇,B-4.0 mmol·L-1醋酸铵-0.1%甲酸水溶液(pH 3.0);梯度洗脱(0~5 min,20% A;5~20 min,20%~80% A)。流速0.3 mL·min1;柱温30 ℃;样品温度4 ℃;进样体积10 μL。 2.2 质谱条件 离子源为电喷雾离子化源(ESI);喷雾电压3 500 V(+);鞘气、辅助气压力均为690 kPa(N2),流速分别为13.3 L·min1和5 L·min1;离子传输毛细管温度350 ℃;选择反应监测模式(SRM)检测,并采用切换阀保护质谱,0~10 min洗脱液切换至废液。4种黄曲霉毒素SRM检测的相关质谱参数见表1。
2.3 供试品溶液的制备 取样品粉末(过3号筛)2.0 g,精密称定,置于50 mL离心管中,精密加入10 mL 84%乙腈,浸泡20 min后500 r·min1涡旋10 min混匀,然后在1 500 r·min1转速下提取60 min,样品于4 ℃,5 000 r·min1下离心5 min,再取250 μL上清液氮气吹干(室温),残渣精密加入1 mL甲醇溶解,最后用0.22 μm微孔滤膜过滤,备用。
3 结果与分析
3.1 专属性试验 分别取苦杏仁的阴性样品溶液、四种黄曲霉毒素的标准品溶液和阳性样品溶液,按2.1项下方法进行检测,记录色谱图,结果见图1。由图中可知,AFG2,G1,B2,B1的保留时间分别为14.23,15.11,15.91,16.62 min,阴性样品在各化合物的RT未见干扰。
3.2 线性关系考察 取黄曲霉毒素对照品溶液,用色谱甲醇以25,50,125,250,1 250,2 500,12 500,25 000,125 000倍稀释,按上述色谱、质谱条件进样分析,以进样浓度为横坐标(X),峰面积为纵坐标(Y),权重W=1/X2,使用Xcalibur 2.0计算线性方程。结果见表2,可见4种黄曲霉毒素在各自浓度范围内具有良好的线性关系。
3.3 检测限(LOD)及定量限(LOQ) 取梯度稀释的对照品溶液,按上述色谱质谱条件注入液质联用仪进行分析,以3/1和10/1的信噪比分别测得四种黄曲霉毒素的LOD和LOQ,结果见表2。
3.4 日内、日间精密度试验 平行取苦杏仁(未污染)粉末3份,每份2.0 g,按2.3项下方法制备供试品溶液,添加特定浓度的对照品溶液,配制成低、中、高3个浓度水平的加标溶液(AFB1,B2,G1,G2的质量浓度依次为0.416,0.126,0.422,0.115;4.16,1.26,4.22,1.15;12.48,3.78,12.66,3.45 μg·L-1),每个浓度各3份,每份样品重复测定2次,连续测定3 d,根据峰面积结果进行方差分析,计算方法的日内精密度和日间精密度。结果显示4种黄曲霉毒素3个浓度水平的日内精密度RSD为1.6%~6.8%,日间精密度RSD为2.3%~6.6%,表明仪器的精密度良好。
3.5 重复性试验 平行取苦杏仁(未污染)粉末9份,每份2.0 g,按照低、中、高3个浓度水平(AFB1,B2,G1,G2的具体浓度与3.4项一致,相当于生药质量浓度依次为8.320,2.520,8.440,2.300;83.20,25.20,84.40,23.00;249.6,75.60,253.2,69.00 μg·kg1)添加黄曲霉毒素对照品溶液,待溶剂挥干后,按2.3项下方法制备供试品溶液,进样分析,根据各浓度峰面积的方差分析,计算方法的重复性。结果见表4,可知4种黄曲霉毒素在3个浓度水平的重复性RSD为2.2%~8.6%,表明方法的重复性良好。
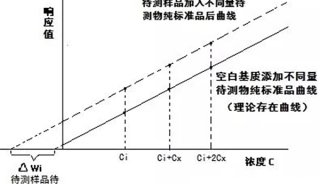
3.6 基质效应考察 按3.4项下方法配制的低、中、高3个浓度的加标溶液,各3份;再用色谱甲醇配制相同浓度的对照品溶液,每个浓度各3份,进样分析,按照以下公式[11]计算2组峰面积的比值,考察苦杏仁的基质效应,结果见表3,表明基质效应的影响可忽略不计。
3.7 回收率试验 平行取苦杏仁(未污染)粉末12份,每份2.0 g,其中3份作为空白对照,另外9份按3.5项下方法制备得低、中、高3个浓度的溶液,每个浓度各3份,进样分析,峰面积记为A;另外取苦杏仁(未污染)粉末3份,每份2.0 g,按3.4项下方法配制成低、中、高3个浓度的加标溶液,每个浓度各3份,进样分析,峰面积记为B;再用色谱甲醇配制相同浓度的标准品溶液,每个浓度各3份,进样分析,峰面积记为C;按照以下公式[11]计算提取回收率RE与绝对回收率RA,结果见表4。
RE=A/B ×100%;
RA=A/C×100%
3.8 方法比较 平行取苦杏仁(未污染)粉末12份,每份2.0 g,其中3份作为空白对照,另外9份按3.5项下方法制备后,取6 mL上清液放入玻璃试管内,Mycosep226柱进行纯化[7](具体操作参照厂家说明),再取250 μL洗脱液氮气吹干,定容,得低、中、高3个浓度的溶液,每个浓度各3份;另外取苦杏仁(未污染)粉末3份,每份2.0 g,按2.3项下方法制备,取6.0 mL上清液放入玻璃试管内,Mycosep226柱进行纯化(具体操作参照厂家说明),再取250 μL洗脱液氮气吹干,按3.4项下方法配制成低、中、高3个浓度的加标溶液,每个浓度各3份;再用色谱甲醇配制相同浓度的标准品溶液,每个浓度各3份;进样分析,分别计算3组样品的峰面积,按照3.7项下公式计算本方法的RE与RA,并与3.7项下的结果进行比较,分析2种方法的差异。结果如表4,可见回收率不纯化>回收率Mycosep226纯化,表明本研究建立的方法回收率更高,损失率更低。 3.9 样品测定结果 分别取收集自广州地区的药店、药材市场和医院的11批苦杏仁药材样品各2份,每份2.0 g,按前述方法进行样品制备和分析,结果见表5。
4 讨论
基质效应是由于样品共流组分对目标化合物离子化效率的影响而引起的,是导致LC-MS/MS定量的不准确的主要影响因素[12]。因此,基质效应的评价在方法学验证阶段尤为重要。减少基质效应主要有以下方法[12]:优化样品前处理技术,比如各种净化柱纯化;稀释样品,降低干扰成分浓度;优化提取溶剂、定容溶剂,提高质谱对目标物的响应;提高色谱分离度,减少共流组分的影响等方法。但目前国内报道的中药材中真菌毒素的LC-MS/MS检测多侧重于样品的前处理技术这一方面,即采用免疫亲和柱或多功能净化柱纯化样品,然而这些方法操作较繁琐,检测成本高,严重限制LC-MS/MS方法的大范围应用。
因此,本研究根据上述减少基质效应的方法,采用稀释法,比较并优化了各种流动相(0.1%甲酸水溶液与甲醇、4.0 mmol·L-1醋酸铵-0.1%甲酸水溶液与甲醇、4.0 mmol·L-1醋酸铵-0.2%甲酸水溶液与甲醇)、洗脱梯度、定容溶剂(流动相、甲醇)等条件,从而提高黄曲霉毒素的响应。最终采用提取后添加法[11]对苦杏仁在低、中、高3个浓度点进行了基质效应考察,实验结果表明,本研究的方法已成功克服基质效应对整个LC-MS/MS定量分析过程的影响,从而可用于苦杏仁中AFB1,B2,G1,G2快速、准确的检测。
同时,通过比较本方法与Mycosep226净化柱的效果,发现2种方法的RA和RE有明显的差异,Mycosep226净化柱纯化后各黄曲霉毒素的回收率均有一定程度降低,说明使用该净化柱纯化的方法会导致目标化合物的损失,这对微量残留的黄曲霉毒素检测极为不利。而本方法不存在以上缺点,且提取、检测过程简便,不仅节省了检测的成本,更提高了结果的准确性,从而可用于苦杏仁的大量筛查。
本实验收集的苦杏仁药材共3种:燀苦杏仁(去种皮)、炒苦杏仁(去种皮)、苦杏仁(未去种皮),检测结果显示3份去种皮的苦杏仁中有2份已污染黄曲霉毒素,而其他未去种皮的苦杏仁均未见污染,推测原因可能是苦杏仁去种皮后种仁的营养物质(油脂、淀粉)完全暴露,更容易被真菌侵染,从而增加污染黄曲霉毒素的风险。因此,苦杏仁污染黄曲霉毒素的这一现象应当引起重视,并且有必要考察其合适的贮藏方式和条件,以降低污染的风险,同时,及早建立相关的限量标准也将有利于降低黄曲霉毒素对消费者的危害性。
本研究为中药材污染黄曲霉毒素的快速检测提供了新的研究思路:通过降低基质成分浓度、优化色谱、质谱条件,减少干扰成分的共流出,有可能克服中药材基质对LC-MS/MS检测的影响,不需昂贵的净化柱即可实现药材的筛查与检测。
-
精英视角

-
综述

-
综述
-
综述

-
企业风采

-
企业风采

-
企业风采

-
产品技术