N-糖基化治疗性抗体—结构、表征方法和治疗潜力的研究
自20世纪80年代以来,单克隆抗体作为治疗性药物得到快速的发展。与小分子药物相比,单克隆抗体的优势在于具有较高的靶向特异性、毒副作用小和半衰期长的优势。而不足之处包含复杂的生产、纯化过程,以及翻译后修饰(PTM)导致单克隆抗体结构和功能的异质性。

在这些翻译后修饰的情况中,Fc区域的糖基化是导致功能异质性的关键,Fc区第297位天冬氨酸(Asn)上有两个保守的N-糖基化位点,其在抗体的效应功能中起重要作用,包括抗体依赖性细胞介导的细胞毒作用(ADCC)、补体依赖的细胞毒作用(CDC),抗体依赖性细胞吞噬作用(ADCP)。此外,有研究结果显示Fc区部分唾液酸化可以使抗体获得抗炎作用。为了更好的利用N-糖基化治疗性抗体的优势,本篇文章作者主要对对Fc区N-糖基化聚糖的结构、表征方法和治疗能力进行详细介绍。
1.N-聚糖的形成
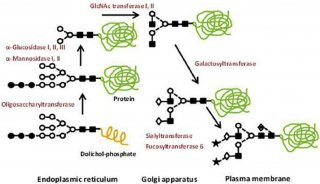
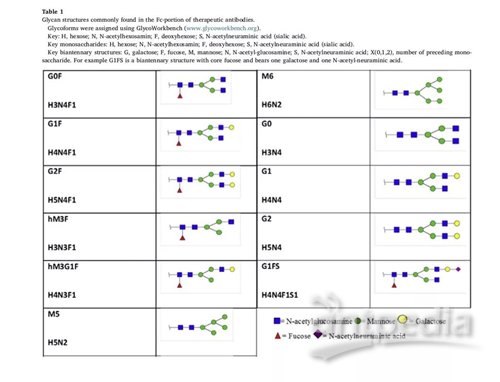
在真核生物中,N-聚糖的形成首先通过寡糖基转移酶复合体识别天冬酰胺-X-丝氨酸/苏氨酸(NXS/T)序列基序,其中X可以是除了脯氨酸以外的任意氨基酸,然后经过翻译后修饰连接到内质网中蛋白质的天冬氨酸残基上。IgG型抗体NXS/T序列基序位于重链的CH2结构域中(图1),表1给出了目前(哺乳动物)细胞培养产生的抗体中产生的最普遍的聚糖结构。

2.形成不同N-聚糖治疗性抗体的因素
(1)细胞系:目前中国仓鼠卵巢(CHO)是用来表达治疗性抗体最广泛的细胞系,研究发现不同的细胞系会导致治疗性抗体的糖基化谱发生改变。例如小鼠细胞两种不同的细胞系SP2/0和NSO,在Fc区会产生两种不同的糖基化聚糖,分别是α,1,3半乳糖糖基化和N-羟乙酰神经氨酸(NGNA);
(2)发酵过程也会影响糖基化谱:例如溶解氧浓度、pH、二氧化碳、温度和生产模式等;
(3)糖基化工程:通过操纵宿主合成途径,例如基于酶化学法的糖基化工程可以用来开发均一糖型的治疗性抗体;还可以通过基因工程的方法,例如敲除岩藻糖转移酶8、过表达半乳糖转移酶和唾液酸转移酶等;另外,酵母不能合成GDP-岩藻糖,可用酵母作为表达系统,生产不含岩藻糖糖型的抗体。
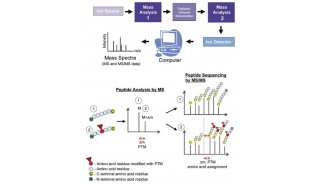
3.表征N-聚糖治疗性抗体的方法
N-聚糖结构具有多样性,其构成异构体的数量、触角形式和亚基之间不同的连接方式都增加了分离和检测的难度。目前基于分离和质谱技术表征N-聚糖治疗性抗体的方法包括(图2):
(1)电喷雾电离质谱(ESI-MS):ESI-MS已成为解决与碳水化合物有关的结构问题的有力工具。ESI-MS在鉴定各种甲基衍生物的碎片、确定各种单糖残基的连接位置非常有用;
(2)酶促(PNGaseF)或化学释放:N-聚糖可以通过N-糖苷酶(PNGase F)或其他烯醇糖苷酶水解从治疗性抗体中解离出来,然后引入荧光基团,例如2-AB、APTS和ANTS,荧光基团可以增强聚糖的色谱和电泳分离能力,提高检测的灵敏度。若不引入荧光基团,可以使用阴离子HPLC分离聚糖,并用HPAEC-PAD检测;
(3)蛋白水解聚糖并检测糖肽:治疗性抗体可以使用蛋白酶酶切抗体,然后使用反相高效液相色谱(RP-HPLC)富集聚糖,分离后用质谱检测糖肽。通过蛋白酶切的方式,对糖肽进行质谱分析,可以了解聚糖的位点特异性。

4. N-聚糖治疗性抗体结构动力学研究
由于受发酵过程因素的影响,生产治疗性抗体时会产生不同N-聚糖构型的治疗性抗体,研究人员对N-聚糖治疗性抗体混合物进行结构动力学研究。
(1)X射线晶体学:利用X射线来研究晶体中原子排列信息,再从中分析获得原子的位置信息,即晶体结构。由于聚糖的灵活性和相关电子密度分散的因素,使用X射线不能完全分解聚糖,但晶体结构结果仍可以看出在CH2结构域内显示出较大的构象异质性。
(2)分子动力学(MD):研究人员利用分子动力学进一步了解聚糖和Fc区结合状态。其结果显示,聚糖中两个支链α,1-6和α,1-3的灵活性不太相同,α,1-6支链在肽相互作用和非相互作用状态之间相互交替,α,1-3只在非相互作用状态中。此外,还证明了碳水化合物(聚糖)和蛋白质相互作用的减少,有利于CH2结构域中碳水化合物的相互作用,从而减少蛋白间相互作用,有利于稳定Fc区与Fcγ受体结合部位的构象。
(3)FTIR和Trp荧光光谱法:虽然荧光光谱法无法显著检测到显著的三级结构,但在过去也被应用于分析聚糖依赖性结构。例如使用荧光光谱法分析具有高甘露糖组成的IgG和去糖基化的IgG,在热解折叠期间高甘露糖IgG显示出解折叠温度降低的趋势。
5.N-聚糖结构对抗体与Fc-受体结合的影响
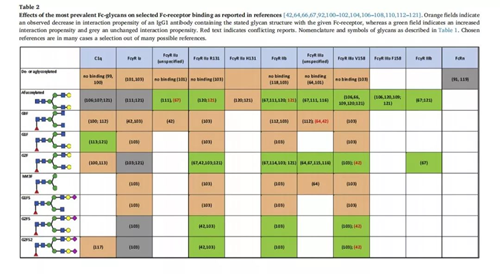
如上所述,聚糖结构会影响Fc结构域的构成空间,从而影响Fc与受体的相互作用。许多研究已经进行了不同聚糖结构的IgG与Fc免疫受体相互作用的实验,作者对其结果进行了概述,如表2所示,其中橙色表示降低抗体与受体的结合能力,绿色表示提高抗体与受体的结合能力,灰色表示为发生改变。
(1)非/去糖基化结构导致大多数IgG无法结合受体,和FcγRIa结合减少;
(2)含有岩藻糖糖基化的抗体对C1q和FcγRIa的结合没有影响,而去岩藻糖基化的抗体对FcγRIIIa和FcγRIIIb受体的结合能力显著增强;
(3)去半乳糖基化(G0)的抗体降低了对C1q和所有FcγR受体的结合倾向。部分半乳糖基化的抗体导致与C1q的结合增加,在完全半乳糖基化后,除了FcγRIa受体,抗体与FcγRs受体的结合均显示小幅度的增加。
(4)不同唾液酸化的聚糖结构显示出与FcγR的不同的结合能力(增高/降低)。
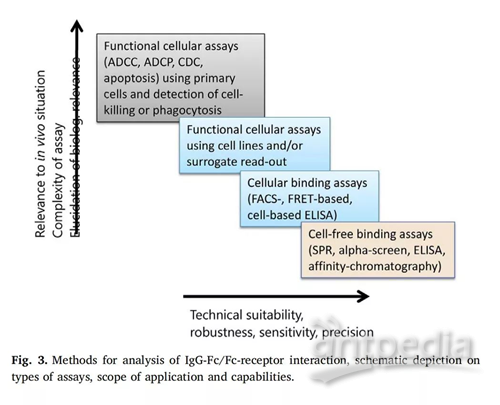
6.评估N-聚糖结构影响抗体与Fc-受体结合的方法
用于分析IgG与不同Fc受体之间相互作用的方法可以概括为三种(表3):
(1)基于细胞杀伤的测定方法:基于ADCC、ADCP和CDC的原理,使用PBMC作为效应细胞,加入抗体后检测靶细胞的裂解、凋亡等情况,其结果能反应抗体的生物效应,这也是体外检测(IgG)Fc介导细胞功能的代表方法。
(2)基于细胞结合的测定方法:通过检测效应细胞的活化情况、检测细胞因子的释放代替检测杀伤或吞噬靶细胞的情况,这种方法有益于提高检测的稳定性和重现性,例如流式细胞分析仪(FACS)、ELISA等;
(3)不依赖于细胞结合实验:无细胞结合实验只关注IgG与不同Fc受体的相互作用,仅需要小剂量就能进行检测,减小其他成分对输出信号因子的影响,最常见的方法有:表面等离子共振(SPR)、荧光能量共振转移(FRET)等。

如图3所示,虽然不依赖于细胞结合实验的检测方法技术可行性高、具有灵敏度,但不能反应体内的真实作用情况。所以,研究中应将高灵敏度的不依赖于细胞结合实验检测技术与相关的体外细胞检测技术相结合,如果条件允许,还可以使用体内数据来表示潜在的生物学相关的结合行为的差异,使研究结果更具说服力。
总结:聚糖结构对抗体的治疗潜力方面有着重要的影响,通过表征聚糖的结构,分析单一聚糖治疗性抗体的功能和治疗潜力,可以针对性地对治疗性抗体进行改造,提高N-聚糖治疗性抗体的临床效果。
参考文献:Florian Cymer, Hermann Beck. et al. Therapeutic monoclonal antibody N-glycosylation – Structure, function andtherapeutic potential. Biologicals (2017), 1045-1056