Ultragenyx/协和发酵麒麟FGF-23靶向单抗Crysvita美国标签更新

Ultragenyx Pharmaceutical Inc是一家专注于开发创新产品治疗严重罕见和超罕见疾病的制药公司。近日,该公司与日本药企协和发酵麒麟(Kyowa Hakko Kirin)联合宣布,美国食品和药物管理局(FDA)已批准Crysvita(burosumab)标签扩展。
该药标签已更新,纳入了新的临床数据,显示Crysvita治疗X-连锁低磷血症(XLH)儿科患者疗效优于口服磷酸盐和活性维生素D(常规治疗),以及Crysvita在长期治疗的成人患者中改善僵硬及维持疗效。此外,Crysvita的适应症也扩大至包括年龄低至6个月大的婴儿。
对于儿科XLH群体,美国标签更新是基于来自一项随机、阳性药物对照III期研究的64周疗效和安全性数据。该研究共入组了61例XLH儿童,比较了Crysvita与口服磷酸盐和活性维生素D(常规疗法)。结果显示,Crystvita在所有关键疗效指标上均优于常规疗法,在佝偻病严重程度、下肢畸形和生长方面有显著改善。64周的安全性与40周和其他Crysvita儿科XLH研究中观察到的相似。
对于成年XLH群体,美国标签更新包含了来自III期临床研究中134例XLH成人患者中治疗至48周的开放标签治疗期结果。结果显示,血清磷水平保持不变,没有失去疗效的迹象。更新的标签还包括显示骨折和假性骨折在第48周持续愈合的结果,以及患者在第24周报告的僵硬结果的改善。安全性与先前在本研究中观察到的一致,在延长治疗期内未发现新的不良反应。
Ultragenyx公司首席医疗官Camille L.Bedrosian表示:“我们很高兴更新的Crysvita标签包含了一项对照临床试验的令人信服的结果,证明Crysvita在使磷水平正常化、减少佝偻病和小腿畸形以及改善XLH儿童的生长方面明显比常规疗法更有效。此外,一项针对成年人的研究中的长期数据显示,在这种终生疾病中,Crystvita具有重要的持续疗效。作为我们支持XLH社区的承诺的一部分,我们与FDA密切合作,更新Crysvita的处方信息,以便医生能够为XLH患者做出更明智的治疗决定,并确保年轻患者可以接受治疗,因为这种疾病在出生时就存在。”
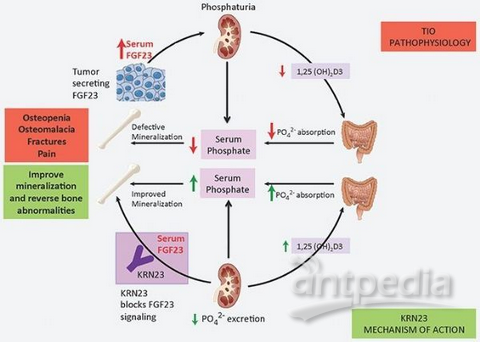
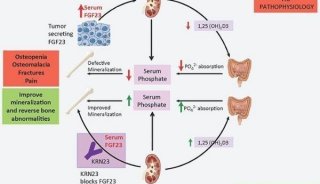
Crysvita(burosumab)作用机制(图片来源:Ultragenyx网站)
Crysvita的活性成分为burosumab,这是一种重组完全人源化IgG1单克隆抗体,靶向结合并抑制成纤维细胞生长因子23(FGF-23)的活性。FGF23通过调节磷酸盐排泄和肾脏内活性生物素D的生成来降低血清里的磷酸盐和活性维生素D水平。FGF-23相关的低磷性佝偻病和骨软化症中的磷酸盐消耗是由FGF-23水平和活性过高所引起的。Crysvita可靶向结合并抑制EGF-23的生物活性。通过阻断患者体内过多的FGF-23,Crysvita可增加肾脏对磷酸盐的再吸收以及增加维生素D的生成,从而也增强肠道对磷酸盐和钙的吸收。
目前,Crysvita正被开发用于治疗与FGF-23相关的低血磷疾病,例如X连锁低磷血症(XLH)、肿瘤诱导的骨软化症(TIO)/表皮痣综合征(ENS)。
Crysvita由协和发酵麒麟与Ultragenyx合作开发。在欧盟和美国,Crysvita分别于2018年1月和2018年4月获得批准,用于治疗1岁及以上儿童和成年人的X-连锁低磷血症(XLH)。之前,Crysvita在美国和欧盟均被授予了孤儿药资格,并在美国获得了突破性药物资格。XLH是儿童遗传性佝偻病最常见的病因,其早期识别对于适当的儿科管理和监测与疾病相关的并发症以及治疗至关重要。
Crysvita是全球首个治疗XLH的药物。定价方面,Crysvita在儿童患者中的定价为每年16万美元,成人为每年20万美元。业界对burosumab的商业前景十分看好,预计其销售峰值将达到10亿美元。
-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐

-
仪器推荐
-
仪器推荐

-
焦点事件