“蜂屯蚁聚”,朱岩团队揭示物种群体形成的秘密
在自然界中,从微生物到人类的很多物种都表现出惊人的聚集成群的现象。同种生物倾向于聚集形成一个紧密群体是非常重要的生存策略,有助于觅食,共同抵御外敌,提升对外界环境变化的敏感度,及增强群体决策等。从无序的个体到高度有序的群体结构的涌现是重要的生命过程,也是理解动物的群体行为起源和稳定机制的重要前提。
已有大量的研究关注于鸟群、鱼群、蝗虫等动物的群体大规模协同运动,提示个体间的相互作用促进了群体的动态特征形成【1-3】。但目前为止,受限于野外观察条件、设备及动物本身的可操作性,个体间的相互作用是如何促进了群体结构的形成和控制成员间社交距离的分子和神经机制仍然不甚清楚,主要原因之一是缺乏有效的实验室条件下的群体行为实验范式。
2020年1月21日,生物物理研究所朱岩实验室在eLife杂志上在线发表题为Emergence of social cluster by collective pairwise encounters in Drosophila的文章,揭示了在实验室条件下果蝇自发聚集形成稳定有序的群体,这个高度动态过程涉及大量、但短暂的个体间相互作用。

果蝇(Drosophila melanogaster)是经典的模式动物,生命科学史上许多重要分子都是先在果蝇中发现并明确其功能的。从生物特性上看,果蝇基因组小,脑神经元数量少,但表现出丰富的行为;果蝇研究还具备便利的遗传操作手段,因此果蝇是研究行为相关的分子和神经机制的首选模型。果蝇通常被认为是非社会性昆虫,但也有研究发现果蝇在没有任何外界刺激诱导时能表现出聚集趋势【4, 5】,那么果蝇是如何自组织聚集成为稳定的群体的?群体内成员间的社会距离又是如何调控的?控制这一行为的神经环路机制是什么样的?
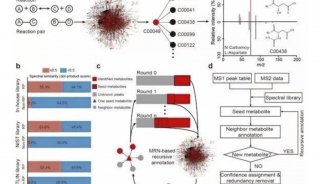
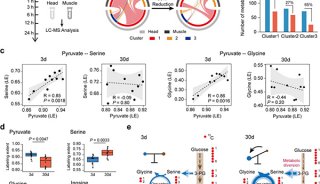
朱岩实验室近年来围绕果蝇社会性的神经机制和分子机制进行一系列研究6。为了深入研究调控果蝇社会行为的机制,该团队通过高分辨行为追踪结合发现聚群行为依赖于大量的、成对的、不对称的、短暂的个体相遇,而且相遇期间两个果蝇的外周器官的触碰是触发这个行为的关键。进一步通过基因突变品系分析、手术介导功能失调等一系列手段研究发现,对于五种主要感知的剥夺会导致非正常的相遇,包括异常高(或低)的相遇频率,相遇时长,瞬时接近速度,改变潜在的群体核心形成的快慢和频率,从而使得整个群体无法形成。此外,通过神经元失活和光遗传激活手段发现ppk特异标记的机械感知神经元在调控自组织行为中起到重要作用。失活ppk神经元抑制果蝇的自组织聚集行为;反之如果激活ppk神经元,果蝇表现为快速聚集并且社交距离显著减小。进一步通过在体功能成像,该团队发现在群体环境中位于果蝇腿部尖端的ppk神经元由于物理接触而被特异性的激活,提示其在群体行为中的重要调控作用。利用计算机模拟长距离吸引作用和短距离排斥作用,他们发现这种高度规则的群体结构可以依赖于局部的个体感知和信息交流来实现。

图1. 果蝇自组织聚集,不对称相遇及ppk神经元的调控。
群体涌现是自然界保守的行为,解析该系统形成的规律及探究其背后的神经生物学机制对认识自然和理解动物行为十分重要。果蝇群体形成中个体间相互交流的规则的发现,对于研究更大规模更复杂的群体行为具有重要的指导价值,为揭开群体行为从发生到神经调控机制等一系列科学问题提供了研究思路和研究平台。这些普适性规则还将为发展人工智能算法,进而通过仿生实现群体类脑智能(机器人群和无人机群的自组织、群体协作和群体智能)提供启发。
博士生姜丽芬为本文第一作者,其他共同作者包括程亚鑫、高山、钟印成、马诚睿、王天宇。朱岩研究员为本文通讯作者。
参考文献
1. Nagy, M., Akos, Z., Biro, D. & Vicsek, T. Hierarchical group dynamics in pigeon flocks. Nature 464, 890-893, doi:10.1038/nature08891 (2010).
2. Jolles, J. W., Boogert, N. J., Sridhar, V. H., Couzin, I. D. & Manica, A. Consistent Individual Differences Drive Collective Behavior and Group Functioning of Schooling Fish. Current biology : CB 27, 2862-2868 e2867, doi:10.1016/j.cub.2017.08.004 (2017).
3. Buhl, J. et al. From disorder to order in marching locusts. Science 312, 1402-1406, doi:10.1126/science.1125142 (2006).
4. Simon, A. F. et al. A simple assay to study social behavior in Drosophila: measurement of social space within a group. Genes, brain, and behavior 11, 243-252, doi:10.1111/j.1601-183X.2011.00740.x (2012).
5. Aike Guo, Z. G., Hao Li, Yan Li, Li Liu, Qingqing Liu, Huimin Lu, Yufeng Pan, Qingzhong Ren, Zhihua Wu, Ke Zhang, Yan Zhu. Vision, Memory, and Cognition in Drosophila. . Learning and Memory: A Comprehensive Reference (Second Edition) Chapter 1.27 483-503, doi:https://doi.org/10.1016/B978-0-12-809324-5.21029-8 (2017).
6. Qiu R, S. Y., Liu L*, Zhu Y*. Higher Brain Functions in Drosophila (review). Progress in Biochemistry and Biophysics 43, 330-336 (2016).
-
焦点事件

-
焦点事件

-
焦点事件