2024年,西湖大学施一公团队合作再取进展
U2小核核糖核蛋白(snRNP)对pre-mRNA分支位点(BS)的选择对于剪接前体 (A complex)的组装至关重要。RNA解旋酶PRP5校对BS选择,但其潜在机制尚不清楚。
2024年1月9日,西湖大学施一公及中国科学技术大学张晓峰共同通讯在Nature Structural & Molecular Biology 在线发表题为“Structural insights into branch site proofreading by human spliceosome”的研究论文,该研究报告了导致前质体组装的两个顺序复合物的原子结构:人类17S U2 snRNP和跨外显子pre-A复合物。
PRP5主要通过酸性环占领SF3B1的RNA通路锚定在17S U2 snRNP上;PRP5的解旋酶结构域与U2 snRNA结合;U2 snRNA与BS相互作用的茎环(BSL)被TAT-SF1屏蔽,无法与BS接合。在pre-A配合物中,形成初始的U2-BS双相;PRP5的易位解旋酶结构域停留在U2 snRNA上,酸性环仍然占据RNA路径。pre-A构象被剪接因子SF1、DNAJC8和SF3A2特别稳定。癌症衍生的SF3B1突变破坏了其与PRP5的关联,损害了BS校对。总之,这些发现揭示了PRP5对剪接前体组装和BS选择或校对的关键见解。
另外,2024年1月2日,上海科技大学刘如娟、西湖大学施一公及圣裘德儿童医院Xu Beisi等团队合作在Nucleic Acids Research 在线发表题为“THUMPD2 catalyzes the N2-methylation of U6 snRNA of the spliceosome catalytic center and regulates pre-mRNA splicing and retinal degeneration ”的研究论文,该研究发现一种RNA修饰-N2 -甲基鸟苷(m2G)沉积在U6 snRNA的G72上(剪接体的催化中心),促进了人类细胞中有效的pre-mRNA剪接活性。这种修饰在脊椎动物中被证实是保守的。通过明确识别U6特异性序列和结构元件,THUMPD2被证明是负责U6 m2G72的甲基转移酶。敲除THUMPD2消除了U6 m2G72,破坏了pre-mRNA剪接活性,导致人类细胞中内源性pre-mRNA的数千个可选剪接事件发生变化。值得注意的是,异常剪接的pre-mRNA群体引发了无义介导的mRNA衰变途径。进一步表明,THUMPD2与年龄相关性黄斑变性和视网膜功能有关。因此,该研究证明了主要剪接体的RNA表观遗传修饰如何调节全局前mRNA剪接并影响生理和疾病。
Pre-mRNA的剪接由剪接体执行,这是一种动态的超分子机器。剪接体通过识别内含子的保守元件:5 ' -剪接位点(5 'SS)、BS、聚嘧啶束(PPT)和3 ' -剪接位点(3 'SS),组装在pre-mRNA上。首先,U1 snRNP、SF1、U2AF2和U2AF1分别识别5'SS、BS、PPT和3'SS,形成E complex。然后,U2 snRNP取代SF1,使U2 snRNA与BS之间形成双工,从而形成A complex。在高等真核生物中,大多数基因通过选择不同的剪接位点进行选择性剪接。因此,选择BS的A complex的形成是剪接调节的焦点。遗憾的是,人们对E-to-A转换背后的步骤知之甚少。
RNA解旋酶PRP5(也称为DDX46)在A complex的组装过程中起关键作用。在人类17S U2 snRNP中,U2 snRNA无法与BS配对,因为U2 snRNA的相关序列形成双链BSL。ATP被PRP5水解导致BSL解绕,从而促进U2-BS双相的形成。在酵母中,Prp5可能校对U2-BS双工,因为Prp5突变允许使用隐性BS和3'SS。然而,PRP5调控剪接保真度的机制尚不清楚。
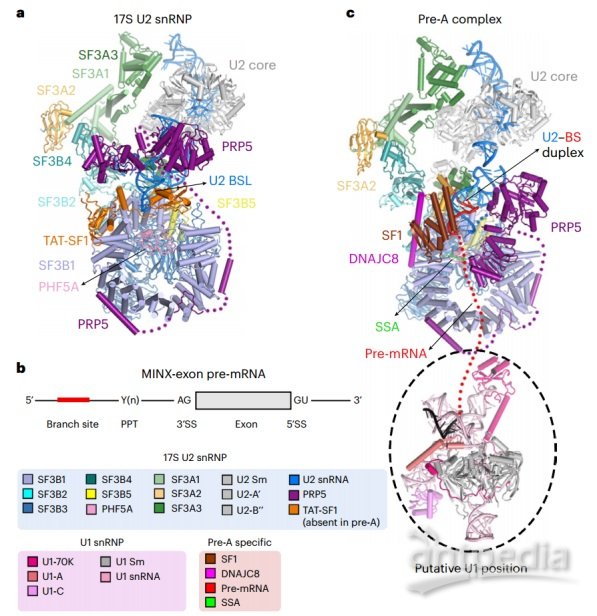
17S人U2 snRNP和人pre-A剪接体的冷冻电镜结构(图源自Nature Structural & Molecular Biology )
大多数已知的癌症衍生的RNA剪接失调突变影响SF3B1的HEAT重复序列中的残基。这些突变大部分聚集在SF3B1的RNA通路上。Hsh155基因中的部分相应突变改变了Prp5相互作用和BS选择。尽管有这些诱人的线索,但这些癌症突变如何干扰正常剪接仍然是一个谜。
该研究报道了人类17S U2 snRNP的高分辨率冷冻电镜(cryo-EM)结构和剪接抑制剂捕获的交叉外显子pre-A complex。结合结构导向的生化分析,该研究提出了一个校对BS选择和A complex组装的工作模型。总的来说,该研究为理解剪接体的早期组装过程以及分支位点的识别和选择机制提供了重要的结构信息,同时也为与癌症相关的SF3B1突变的致病机制提供了新的见解。
原文链接:https://www.nature.com/articles/s41594-023-01188-0
-
焦点事件













