前剪接体和剪接体的分离及分析实验
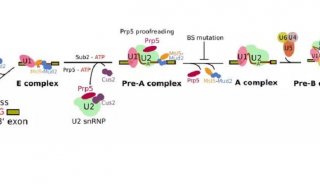
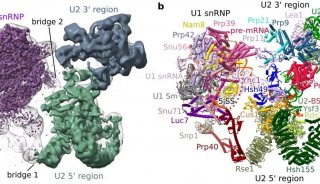
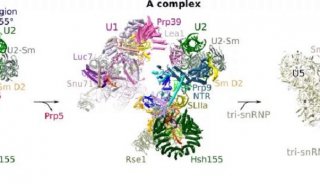
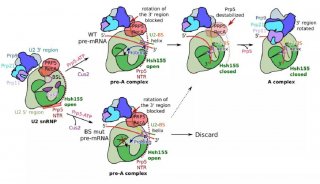
实验方法原理 剪接体是由 RNA 和蛋白质构成的核糖核蛋白体(RNP),它在前体 mRNA 的剪接过程中可去除前体 mRNA 的内含子。snRNP 是由 snRNA 及其结合蛋白组成,在前体 mRNA 的剪接过程起着重要作用。
实验材料 PIP 10 载体核苷酸焦磷酸酶RNasinT7 RNA 聚合酶mRNA
试剂、试剂盒 转录缓冲液高盐缓冲液NaAc乙醇TBE 电泳缓冲液丙烯酰胺溶液过硫酸铵TEMED变性凝胶上样缓冲液凝胶冼脱缓冲液磷酸肌酸肝素密度梯度溶液两性电解质溶液SDS 凝胶银染溶液
仪器、耗材 玻璃板聚丙烯酰胺凝胶电泳装置
实验步骤
一、材料与设备
1. 体外转录
(1) 特异性酶切用于体外转录的模板(PIP 10 载体)。
(2) 核苷酸:10 mmol/L 生物素-21-UTP,10 μCi/μl [α-32P] UTP,10 mmol/L UTP,10 mmol/L (ATP、CTP、GTP)。
(3) 12X 转录缓冲液:480 mmol/L Tris-HCl(pH 8.1),72 mmol/L MgCl2,12 mmol/L 亚精胺,60 mmol/L DTT,0.2% Triton X-100,960 g/ml 聚乙二醇(PEG)。
(4) 焦磷酸酶(0.05 U/μl)。
(5) RNasin(40 U/μl)。
(6) T7 RNA 聚合酶。
(7) 高盐缓冲液:10 mmol/L Tris-HCl ( pH 7.5 ),100 mmol/L LiCl,10 mmol/L EDTA,0.5% SDS,7 mol/L 尿素。
(8) 3 mol/L NaAc ( pH 5.2)。
(9) 100% 和 80% 乙醇。
2. 采用变性凝胶纯化前体 mRNA 并分析剪接产物
(1) 玻璃板(27cm X 16.5 cm ) 和聚丙烯酰胺凝胶电泳装置。
(2) 5X TBE 电泳缓冲液:446 mmol/L Tris,445 mmol/L 硼酸,1 mmol/L EDTA。
(3) 15% 丙烯酰胺溶液:1X TBE,14.5% 丙烯酰胺,0.5% 甲叉双丙烯酰胺,8 mol/L 尿素。
(4) 10% 过硫酸铵。
(5) TEMED。
(6) 变性凝胶上样缓冲液:98% 甲酰胺,10 mmol/L EDTA,0.025% 二甲苯蓝,0.025% 溴酚蓝。
(7) 凝胶冼脱缓冲液:10 mmol/L Tris-HCl ( pH 7.5),0.5 mol/L 乙酸铵,10 mmol/L 乙酸镁,0.1 mmol/L EDTA,0.1% SDS。
3. 剪接反应
(1) PIP 10 前体 mRNA ( 0.13 mg/ml )。
(2) HeLa NE 或 DEAEⅡ。
(3) 400 mmol/L KCl。
(4) 100 mmol/L MgCl2。
(5) 10 mmol/L ATP 和 50 mmol/L 磷酸肌酸。
(6) 50 mg/ml 肝素。
4. 甘油梯度
(1) 密度梯度溶液:15% 或 30% (V/V)甘油溶于 6.4 mmol/L HEPES-KOH 中(pH 7.9 ),50 mmol/L KCl,2 mmol/L MgCl2。
(2) 梯度 Marker GA. 2994 ( Gibco-BRL,GrandIsland,NY,USA )。
(3) Beckman 同质择晶(polyllomer ) 聚合离心管(14 mm X 95 mm)。
5. 非变性凝胶
(1) 玻璃板 ( 17 cm X 16.5 cm )。
(2) 30% ( m/V ) 溶于蒸馏水的丙烯酰胺。
(3) 1% ( m/V ) 溶于蒸馏水的甲叉双丙烯酰胺。
(4) 1 mol/L Tris ( 非缓冲,pH 约为 6.0)。
(5) 1 mol/L 甘氨酸(非缓冲,约为 6.0 )。
(6) 10% 过硫酸铵。
(7) TEMED。
(8) 电泳缓冲液:50 mmol/L Tris,50 mmol/L 甘氨酸。
6. 亲和纯化
(1) 链亲和素磁珠(10 mg/ml)。
(2) 牛血清白蛋白。
(3) 5X 结合缓冲液:6.4 mmol/L HEPES-KOH ( pH 7.9 ),50 mmol/L KCl,12.5 mmol/L EDTA,0.5% Triton X-100。
(4) 1 mol/L DTT。
(5) RNasin(40 U/μl)。
(6) 洗涤缓冲液 1:20 mmol/L Tris ( pH 7.9 ),250 mmol/L NaCl。
(7) 洗涤缓冲液 2:20 mmol/L Tris ( pH 7.9 ),100 mmol/L NaCl。
(8) RNase A(0.2 mg/ml)。
(9) 洗脱缓冲液:20 mmol/L Tris-HCl ( pH 7.9),20 mmol/L DTT,2% SDS。
(10) 糖原(20 mg/ml )。
(11) 丙酮。
7. 蛋白质的双向电泳
(1) 两性电解质溶液:22.4 mmol/L Tris-HCl,17.6 mmol/L Tris 碱,7.92 mol/L 尿素,0.06% SDS,1.76% pH 3.0~10 的两性电解质,120 mmol/L DTT,3.2% Triton X-100。
(2) 预制的 pH 3.0~10 两性电解质 IEF 凝胶(1 mm X 18 cm)(ESA、Chelmsford、MA )。
(3) IEF 电泳缓冲液:10 mmol/L 磷酸阳极溶液,100 mmol/L NaOH 阴极溶液。
(4) 凝胶平衡缓冲液:300 mmol/L Tris 碱,75 mmol/L Tris-HCl,50 mmol/L DTT,3% SDS,0.01% 溴酚蓝。
(5) SDS 凝胶:373 mmol/L Tris ( pH 8.8 ),9% 丙烯酰胺,0.1% SDS,0.02% 过硫酸铵,0.005% TEMED。
(6) SDS 电泳缓冲液:25 mmol/L Tris 碱,192 mmol/L 甘氨酸,0.1% SDS。
(7) 银染溶液:2% ( m/V ) 柠檬酸钠,0.8%(m/V) 硫酸亚铁,0.1% ( m/V ) 硝酸银。用锡箔包住于 4℃ 保存。
二、操作方法
1. 转录
这种 1 ml 的大规模体外转录反应在凝胶纯化后可得到 100 μg 的前体 mRNA。
(1) 为防止 DNA 沉淀,在室温按顺次加入下列成分:83.3 μl 12X 转录缓冲液,100 μl 100 mmol/L MgCl2,200 μl(10 mmol/L ATP、CTP、GTP),37.5 μl 10 mmol/L UTP,37.5 μl 10 mmol/L 生物素-21-UTP,30 μl 10 μCi/μl [ α-32P ]-UTP,2 μl RNasin(40 U/μl),10 μl 焦磷酸酶(0.05 U/μl),80 μl 1 mg/ml PIP 10 HindⅢ 消化的质粒(PIP 10),22 μl T7 RNA 聚合酶,最后加蒸馏水至 1 ml。
(2) 37℃ 温育 3 h。
(3) 加入 1/10 体积 3 mol/L 乙酸钠(pH 5.2)和 2.5 体积的乙醇。
(4) 在干冰上沉淀 20 min,再在 4℃,16000 g 离心 20 min。用冷的 80% 乙醇洗沉淀,空气干燥。
2. 变性凝胶纯化前体 mRNA 并分析剪接产物
(1) 清洗并组装玻璃板。
(2) 加 115 μl 10% 过硫酸铵和 11.5 μl TEMED 到 21 ml 的 15% 丙烯酰溶液中。
(3) 把混合物灌入玻璃板之间,插上梳子。
(4) 凝胶聚合 1 h 以后拔出梳子。
(5) 用变性凝胶上样缓冲液溶解 RNA,100°C 加热 3 min 变性,立即置于冰上直至上样。
(6) 用 60 V/cm 的电压预电泳 15 min。
(7) 冲洗加样孔并上样。
(8) 电泳约 2.5 h,直至两种指示剂都泳出凝胶。
(9) 去掉上面的玻璃板,用塑料膜盖住。在凝胶上放一个荧光尺以确定 X 射线片的位置。
(10) 对 X 射线片曝光,确定 RNA 转录物的位置。
(11) 从凝胶上切下含 RNA 的带,研碎,加入 500 μl 凝胶洗脱缓冲液,4℃ 摇过夜或 37℃ 摇几小时。
(12) 通过一次性柱离心去掉凝胶碎片。
(13) 按操作1 “转录” 的方法用乙醇沉淀 RNA。
(14) 用 500 μl 蒸馏水溶解 RNA,-20℃ 保存。
3. 大规模剪接反应
(1) 混合下列成分:56 μl 100 mmol/L MgCl2,119 μl 400 mmol/L KCl,280 μl 10 mmol/L ATP,50 mmoI/L 磷酸肌酸,30 μl 0.1 μg/μl 生物素化的前体 mRNA,1.12 ml NE 或 DEAEⅡ,最后加蒸馈水至 2.1 ml。
(2) 30℃ 温育 1 h。
(3) 加入 1/100 体积的肝素(5 mg/ml),30℃ 温育 5 min。
4. 甘油梯度
(1) 用前迅速灌制三个 13 ml 的甘油密度梯度。7 ml 30% 甘油梯度溶液在梯度标记的 “重” 槽,7 ml 15% 甘油梯度溶液在 “轻” 槽。
(2) 在每一梯度管上铺 690 μl 剪接反应液。
(3) 用SW-40Ti 转子在 4℃,以 40000 r/min 的转速(285000 g)离心 8 h。
(4) 从顶层到底部小心收集组分,每 1 ml 一份。
5. 非变性凝胶
(1) 洗涤并组装玻璃板。
(2) 混合 5.6 ml 30% 丙烯酰胺、2 ml 1% 平叉双丙烯酰胺、2 ml 1 mol/L Tris、2 ml 1 mol/L 甘氨酸、28 ml 水、0.28 ml 10% 过硫酸铵、28 μl TEMED。
(3) 在玻璃板间灌制凝胶,插上梳子。
(4) 聚合 2~4 h 后,拔掉梳子。
(5) 每一个甘油梯度取 20 μl 上样。
(6) 160 V 电压(9.4 V/cm ) 电泳。
(7) 电泳结束后,取下凝胶放在一张 Whatman 3 MM 滤纸上,80℃ 真空干燥 45 min。
(8) 放射自显影显示剪接复合物。
6. 亲和纯化
(1) 预封闭链亲和素磁珠。用含 0.1% BSA 的 1X 结合缓冲液洗 4 次,共超过 2 h。
(2) 合并含剪接体的甘油梯度。
(3) 在合并的溶液中加入 1/5 体积的 5X 结合缓冲液,2 mmol/L DTT,3.2 U/ml RNasin,64 μl/ml 链亲和素磁珠。
(4) 4℃ 揺过夜。
(5) 收集磁珠,加入10 ml 洗涤缓冲液1,4℃ 摇 15 min 以洗涤磁珠。重复洗涤 3 次。
(6) 用洗涤缓冲液 2 洗涤一次。
(7) 用 0.5 ml 洗涤缓冲液 2 重悬。
(8) 加 2 μl 0.2 mg/ml 的 RNase A,30℃ 温育 10 min。
(9) 回收并保存上清。
(10) 用 0.5 ml 洗脱缓冲液洗磁珠 3 次,并把洗脱缓冲液与保存的上清合并,共约 2 ml。
(11) 65℃ 加热洗脱液 5 min。
(12) 加入 2 μl 20 mg/ml 的糖原和 4 倍体积的丙酮。
(13) 室温孵育 10 min,室温 2800 g 离心 10 min,收集沉淀的蛋白。
(14) 去掉上清,让沉淀在室温干燥 15 min。
7. 双向凝胶电泳
(1) 按操作说明装配 InvestigatorTM 2-D 电泳系统(ESA,Chelmsford,MA,USA )。
(2) 在 15 μl Ampholyte 两性电解质溶液中重悬亲和纯化并用丙酮沉淀的蛋白。
(3) 16000 g 离心 1 min,把上清上样到预制的等电聚焦(IEF) 凝胶上。
(4) 100 V 电泳 1 h,200 V 电泳 1 h,400 V 24 h,650 V 1 h,1000 V 30 min,1500 V 10 min,2000 V 5 min,总共约为 11250 V-h。
(5) 把凝胶挤进凝胶平衡缓冲液中,室温孵育 5 min。
(6) 把 IEF 凝胶铺到 SDS 凝胶上,电泳至溴酚蓝离底部 1 cm。
(7) 银染凝胶分析蛋白质组分。在蛋白质测序前可加大蛋白的上样量以用考马斯亮蓝或银染色的方法检测。
-
焦点事件

-
技术原理