Acceleron/BMS TGF-β配体陷阱sotatercept获FDA突破性药物资格!
Acceleron Pharma是一家致力于发现、开发和商业化TGF-β超家族疗法用于治疗严重和罕见疾病的生物制药公司,近日,该公司宣布,美国食品和药物管理局(FDA)已授予sotatercept(ACE-011,ActRIIA-Fc)治疗肺动脉高压(PAH)患者(WHO第1组)的突破性药物资格(BTD)。在2019年9月,FDA还授予了sotatercept孤儿药资格(ODD)。
突破性药物资格(BTD)是FDA在2012年创建的一个新药评审通道,旨在加快开发及审查用于治疗严重或威及生命的疾病、并且有初步临床证据表明该药与现有治疗药物相比能够实质性改善病情的新药。获得BTD的药物,在研发时能得到包括FDA高层官员在内的更加密切的指导,在新药上市审查有资格进行滚动审查和优先审查,以保障在最短时间内为患者提供新的治疗选择。
sotatercept是一种研究性药物,旨在作为TGF-β超家族成员的一种选择性配体陷阱,以重新平衡PAH的关键驱动因子——BMPR-II信号传导。在PAH的临床前研究中,sotatercept逆转了肺血管肌肉化并改善了右心衰指标。
今年1月底,Acceleron公布了II期PULSAR试验的顶线分析结果,显示研究达到了主要终点、关键次要终点和其他次要终点。不良事件与之前公布的sotatercept在其他疾病中的不良事件一致。作为与新基(已被百时美施贵宝收购)授权协议的一部分,sotatercept也正在II期SPECTRA试验中进行评估。
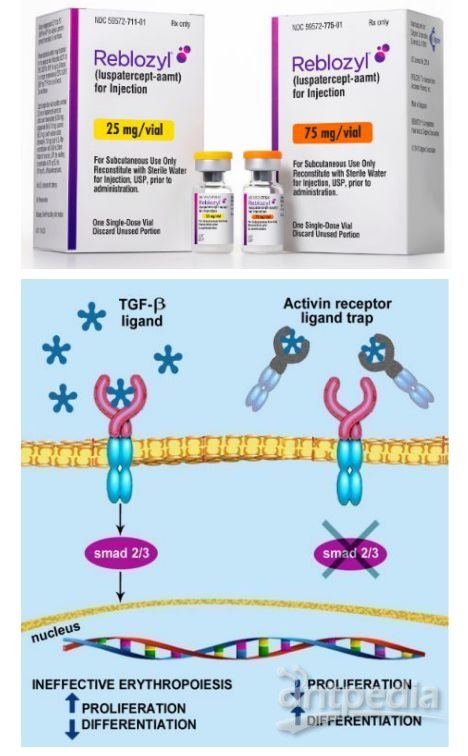
值得一提的是,就在最近,Acceleron与新基合作开发的另一款TGF-β配体陷阱药物Reblozyl(luspatercept)获美国FDA批准新适应症,用于低危骨髓增生异常综合症(MDS)成人患者,治疗贫血。Reblozyl是第一个也是唯一一个获得FDA批准的红细胞成熟剂,代表了新一类的疗法,通过调节红细胞成熟后期阶段来帮助患者减少红细胞输注负担。在美国,Reblozyl于2019年11月首次获批,用于需要定期输注红细胞的β地中海贫血(beta thalassemia)成人患者,治疗贫血。
值得一提的是,Reblozyl是第一个获FDA批准治疗β地中海贫血相关贫血的药物,同时也是十多年来第一个获FDA批准用于需要输注红细胞(RBC)且接受一种红细胞生成刺激剂治疗失败的MDS患者的新治疗方案。需要指出的是,在需要立即纠正贫血的患者中,Reblozyl不适用于作为红细胞输注的替代品。
Reblozyl的活性药物成分为luspatercept,这是一种首创的(first-in-class)红细胞成熟剂(EMA),可调节晚期红细胞的成熟。该药是一种可溶性融合蛋白,由人IgG1的Fc结构域与激活素IIB型受体(ActRIIB)胞外结构域融合而成,作为一种配体陷阱,通过靶向结合可调节晚期RBC成熟的转化生长因子(TGF)-β超家族的特定配体,减少Smad2/3信号通路的激活,改善无效红细胞的生成,促进晚期红细胞的成熟,提高血红蛋白水平。