基于Q-OT-qIT 平台的第二代“三合一”超高分辨质谱介绍
摘 要 Orbitrap Fusion Lumos 是基于Q-OT-qIT 平台的第二代“三合一”质谱,通过离子入口、离子透镜、四极杆、ETD和真空技术等方面的深度改进,将仪器整体性能优化至极致。配合“三合一”质谱魔法般的功能,Orbitrap Fusion Lumos 能够有效应对蛋白质组学和代谢组学最复杂的分析挑战。本文从定性定量极限灵敏度、抗污染性能、翻译后修饰和top-down 解析等方面,介绍了第二代“三合一”质谱的性能突破和应用进展。
关键词 Orbitrap Fusion Lumos, 蛋白质组学, 代谢组学, top-down
中图分类号 TH843
Orbitrap Fusion Lumos: Second Generation of “Tribrid” UHR-MS Based Q-OT-qIT
Zhang Wei
ThermoFisher Scientific, Shanghai 201206, China
Abstract Orbitrap Fusion Lumos is the second generation of “Tribrid” MS based on Q-OT-qIT system. The ion inlet, ion optics, quadrupole, ETD and vacuum system are deeply improved, and the instrument performance is extremely optimized. Combined with various magic functions on “Tribrid”, the new system can effectively face the extreme challenge in proteomics and metabolomics. This paper introduces the improvements and advances of the new “Tribrid” MS, including enhanced qual/quan sensitivity, robustness, PTM elucidation and top-down analysis.
Key words Orbitrap Fusion Lumos, Proteomics, Metabonomics, top-down
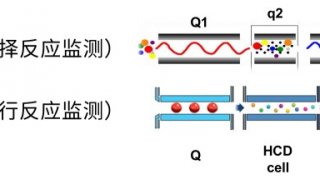
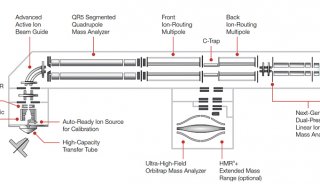
近年来质谱技术呈几何式发展,从过去单一质量分析器质谱(如单四极杆Q)、到两个质量分析器组成的串联质谱(如四极杆- 飞行时间Q-TOF),再到拥有两种检测器的组合型质谱(如线性离子阱- 静电场轨道阱LTQ-Orbitrap),不断创新与突破。2013 年,Thermo 基于四极杆- 静电场轨道阱-线性离子阱(Q-Orbitrap-LTQ 或称Q-OT-qIT)结构,发展了世界上第一款将三种质量分析器集为一体的“三合一”质谱Orbitrap Fusion [1]。利用四极杆的高选择性和宽线性、静电场轨道阱的超高分辨率和超高质量精度、线性离子阱的超高灵敏度和多级MSn 分析能力,并让各质量分析器相互配合、平行工作,从而获得革命性的扫描方式、魔法般的分析功能和无与伦比的仪器性能。“三合一”质谱可以解决从定性鉴定、到结构解析、再到精确定量的所有工作。特别是对蛋白质组学的推动,一个小时完成了酵母全部蛋白的鉴定,开创了“一小时蛋白质组学”的先河[2]。
2015 年美国质谱年会,基于对Q-OT-qIT 系统的深度优化,Thermo 推出了第二代“三合一”质谱—— Orbitrap Fusion Lumos。“Lumos”一词本意是点亮魔杖荧光的咒语,第二代“三合一”质谱魔法般的功能和优化至极致的性能,配合智能平行运行技术(ADAPTTM)将质谱所有部件充分调动起来,相互配合、同时工作,从而轻松应对最复杂的分析挑战,就像魔杖荧光一样照亮未知的分析领域。
1 极低丰度蛋白/ 化合物的鉴定
第二代“三合一”质谱使用全新高容量离子传输管(HCTT)和电动离子漏斗(EDIF),通过大口径的离子入口透镜,让更大量离子进入质谱,配合主动离子束传输组件(AABG),有效聚焦和传输离子,从而全面突破仪器灵敏度的瓶颈与极限。实验数据表明,全新的离子入口与离子透镜设计使纳升流速和常规流速的检测灵敏度分别提高2 倍和5 倍[3]。灵敏度的提高不仅降低了最低检测限和最低定量限,更有效提升了多级解析的信号响应,1 ng/mL 噻吗洛尔(Timolol)碎裂至5 级,仍然获得高质量的谱图,实现精细结构有效解析。
此外,全新三段式四极杆(AQT)的设计使被分析物始终处于四极场的稳定区,从而稳定地通过四极杆,显著提高离子选择效率,避免了选择窗口边缘和高质量的歧视效应。离子透镜的改进再配合全新三段式四极杆,使复杂样本高通量鉴定达到新高度:1 μg HeLa 细胞总蛋白,140 分钟梯度,2 次重复,共鉴定到5211 个非冗余蛋白。使用0.4、0.7、1.6m/z 三种选择窗口分别鉴定到5211、5184、5187 个非冗余蛋白,窗口的缩小没有降低灵敏度,反而进一步排除了共流出肽段干扰,使极低丰度蛋白的鉴定更加灵敏、准确。癌细胞系总蛋白分析,分级12 组分,共鉴定109578 条非冗余肽段,对应10210 个非冗余蛋白,轻松实现蛋白质组深度覆盖。此外,进一步升级的“Universal Method”无需针对样本量优化最佳参数,一个方法适用于所有未知浓度样本分析,无论是极低上样量还是高上样量都能获得最佳结果。
2 适应大规模临床样本的7x24 小时检测
复杂样本的7x24 小时连续分析对质谱抗污染能力是一大挑战,特别是多肽/ 蛋白等大分子量的离子,会对质量分析器产生严重污染,造成灵敏度下降等后果。第二代“三合一”质谱的全新预四极杆(Q00),其结构与主四极杆类似,由具有选择能力的四根圆杆组成。这样的设计使全新预四极杆相比常规预四极杆,具有更高效的离子预筛选能力,无论在何种扫描模式下,预四极杆都会高效率地将目标选择范围之外的高分子量离子(通常m/z >1300)排除,阻止高分子量离子进入质量分析器形成污染[4]。高分子量离子的有效排除极大提高了仪器的抗污染能力,即便是诸如血浆、组织等高度复杂的临床样本,也能在大规模、高通量的高强度分析下,持续保持仪器的高灵敏度和低杂质噪音。
3 最精确的定量分析
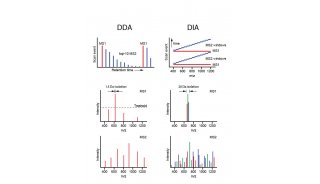
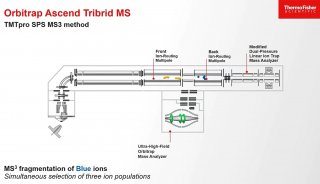
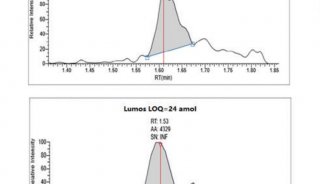
灵敏度和选择性的提高,使复杂基质中极低丰度蛋白/ 化合物的定量更加灵敏、更加准确[5, 6]。平行反应监测(PRM)定量,在200 ng HeLa 基质样品中定量15 条合成肽段(PRTC 重标肽),其中10条肽段LOQ 达5 amol(10-18 mol)及以下,CV 均小于10%。数据非依赖采集(DIA),以Q ≤ 0.01 和CV ≤ 20% 为标准,155 分钟有效梯度从HeLa 细胞总蛋白中鉴定并定量了44506 条肽段和5277 个非冗余蛋白,谱图库中80% 的蛋白获得了准确、可靠的定量信息。基于稳定同位素标记的Shotgun 定量,使用1 μg TMT 标记的HeLa 细胞总蛋白进行同步母离子选择(SPS)MS3 定量分析,定量肽段数量比过去提高了37%,若将样本稀释100 倍,即10 ng上样量,定量肽段数量则提高了300%。第二代“三合一”质谱是极低丰度蛋白/ 化合物定量的利器,实现从shotgun 大规模定量,到DIA 定量,再到PRM目标定量的全面提升。
4 最清晰的修饰结构解析
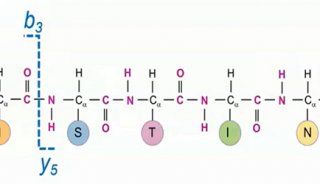
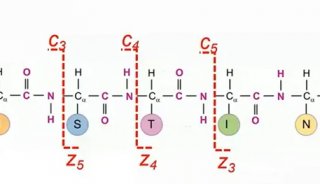
通过ETD 碎裂获得精确的位点和结构信息是翻译后修饰研究的有效手段。传统ETD 应用于临床研究时,由于临床样本的复杂性导致ETD 碎裂灵敏度低、碎裂效果差,尚难作为常规裂解手段用于临床样本研究。高清ETD(ETD HD)的发展彻底改变了ETD 的诸多不足。ETD HD 利用线性离子阱的中段阱稳定和储存母离子,再与荧蒽发生ETD 反应,使灵敏度、动态范围、二级谱图质量显著提高[7]。ETD HD 配合Easy-ETD 源、智能母离子排序、实时产物离子触发、EThcD/ETciD 等多种创新模式,使复杂基质中极低丰度蛋白的翻译后修饰分析,特别是糖基化结构解析成为可能。使用ETD HD 分析人血清富集的糖蛋白,2 小时梯度,2 次重复,共解析超过1000 种不同糖型结构的完整糖肽,其中大部分是分子量超过5 kDa 的糖肽。第二代“三合一”质谱的ETD 已成为一种简单、高效的碎裂模式,能有效应用于复杂样本低丰度蛋白的分析。
5 Top-Down 研究的新纪元
Top-Down 研究经过多年的发展仍面临诸多瓶颈,而突破瓶颈的关键在于减少完整蛋白在传输过程中的损失,以及提高蛋白中间序列的碎裂效率。基于第二代“三合一”质谱的深度高真空技术(Advanced vacuum technology),通过多种技术手段组合,进一步提高了仪器的整体真空度,特别是C-trap 和Orbitrap 之间的真空度,最大程度避免完整蛋白从C-trap 弹射到Orbitrap 过程中与残留气体碰撞造成的损失[8]。实验结果表明,深度高真空技术使完整碳酸酐酶检测的信噪比提高3 倍,再配合ETD HD 碎裂,使碳酸酐酶的碎片覆盖度从38% 提升到65%。同样的方法进行IgG Top-Down 分析,轻链的碎片覆盖度达91%,重链的碎片覆盖度达63%[9]。此外,利用三段式四极杆的高选择性,使用0.5m/z 窗口筛选不同甲基化程度的组蛋白H3 完整蛋白(18+),实现分子量相近(间隔仅为0.78 m/z)的不同蛋白变体(Proteoform)的有效隔离和区分。深度高真空技术、ETD HD、三段式四极杆等创新技术的发展,全面突破了Top-Down 分析的瓶颈,使复杂样品的在线LC-MS Top-Down 分析成为可能,Top-Down 研究进入新纪元。
综上所述,第二代“三合一”质谱—— Orbitrap Fusion Lumos 通过诸多技术革新和性能深度优化,解决了极低丰度蛋白/ 化合物定性定量、复杂糖肽结构解析、完整蛋白Top-Down 分析等最具挑战的疑难问题,能够有效应用于大规模临床样本的7x24小时高强度检测。
参考文献
[1] Senko MW, Remes PM, Canterbury JD, et al. (2013) Novel Parallelized Quadrupole/Linear Ion Trap/Orbitrap Tribrid Mass Spectrometer Improving Proteome Coverage and Peptide Identification Rates. Anal. Chem. 85: 11710-11714
[2] Hebert AS, Richards AL, Bailey DJ, et al. (2014) The One Hour Yeast Proteome. Mol. Cell. Proteomics 13: 339-347
[3] Wouters ER, Prasad S, Dunyach JJ. Advancements in Atmospheric-Vacuum Interfaces of Mass Spectrometers with Increased Gas Throughput and Enhanced Sensitivity. ASMS 2015: PN 64478
[4] McAlister GC, Senko M. Pre-filtering Ions in the Source Region to Improve Instrument Robustness and Dynamic Range. ASMS 2015: PN 64475
[5] Blank M, Huguet R, Bomgarden R, et al. Revolutionizing Data Independent Acquisition on q-OT-IT Tribrid Mass Spectrometers. ASMS 2015: PN 64461
[6] Huguet R, Blank M, Soltero N, et al. Low Attomole Limit of Quantification on an Orbitrap Fusion Lumos Tribrid Mass Spectrometer. ASMS 2015: PN 64492
[7] Mullen C, Earley L, Weisbrod C, et al. Considerations for Attaining Improved ETD Performance for Top Down Applications. ASMS 2015: 64463
[8] Canterbury J, Izgarian N, Senko M, et al. Improvements for High Resolution Analysis on a Modified Tribrid Mass Spectrometer. ASMS 2015: PN 64468
[9] Sharma S, Mallick P, Stoyanova T, et al. Optimizing Top Down Analysis of Proteins on Orbitrap Fusion ™ Lumos ™ Tribrid ™ Mass Spectrometer. ASMS 2015: PN 64439