上海科学家揭示炎症信号促进肝脏再生机制
2月13日,国际学术期刊CellStemCell在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)惠利健研究组与中国科学院上海营养与健康研究所李虹研究组和李亦学研究组合作的研究文章:“kupffer cell-derived il-6 is repurposed for hepatocyte dedifferentiation via activating progenitor genes from injury-specific enhancers”。这项机制研究揭示肝脏损伤下,驻留Kupffer细胞分泌的炎症信号IL-6诱导了肝细胞的去分化并表达前体基因。信号转导机制上,IL-6是损伤特异的信号,该信号通过肝细胞表达的受体IL6R/gp130能直接激活肝细胞STAT3信号通路诱导肝细胞去分化。转录调控机制上,STAT3作为转录因子能结合在损伤特异的增强子上,促进了肝前体基因的表达。由于IL6/STAT3在胚胎发育中不表达,而且重编程相关基因活化位点与发育过程完全不同,表明这是损伤特异而非发育相关的转录调控机制。

组织再生过程中新生细胞的来源主要分为两种,一种是来自于成体干细胞自我扩增并分化,另一种是来自于原先存在的已分化的细胞。在后者相关的研究领域发现,已分化的细胞可以经历一个去分化或者重编程的过程贡献组织的再生,并且在多个组织中都有发现,例如肺、小肠、胰腺和肝脏。在肝脏的损伤再生过程中,已有研究表明,成熟肝细胞的去分化过程是肝细胞重要来源之一。肝脏损伤下成熟肝细胞能发生去分化过程,转变成Sox9+类肝前体细胞(Liver progenitor-like cells,LPLCs)贡献肝脏内细胞的来源。
肝脏分子病理研究团队惠利健研究组在2019年发表的Cell Stem Cell论文中的工作证明,肝细胞具有重编程能力的内在特性是受到Arid1a调控,Arid1a预先开放了成熟肝细胞中重编程相关基因(Reprogramming related genes,RRG)的染色质,从而使得成熟肝细胞可以响应损伤信号发生重编程,称为重编程感受态(Reprogramming competence),为重编程的发生提供了分子基础。那是什么外源信号诱导了重编程的发生呢?损伤下肝细胞重编程发生通常是在一个特定的区域内,因此,这些损伤外源信号应该也存在特异的区域分布。此外,RRG基因很多都是胚胎发育相关,是否肝细胞去分化利用了胚胎时期的信号,重新在损伤过程激活了这些RRG基因?或者有损伤特定机制另外调控了这些RRG基因?

单细胞测序解析肝细胞重编程的轨迹及激活的信号通路
在该研究中,惠利健组研究人员利用单细胞测序的手段,解析了健康的肝脏和损伤肝脏里的肝细胞不同亚群的表达谱,鉴定到损伤出现的Sox9+LPLCs。LPLCs的特征基因同样在肝胚胎发育过程中高度富集,说明肝细胞去分化重新激活了胚胎发育时期的基因。通过伪时间分析,结合单样本GSEA富集分析,研究人员解析了从正常肝细胞转变到LPLCs过程中激活的信号通路,发现免疫信号通路在转变过程中高度激活,并且免疫信号通路的激活程度与重编程轨迹呈正相关。
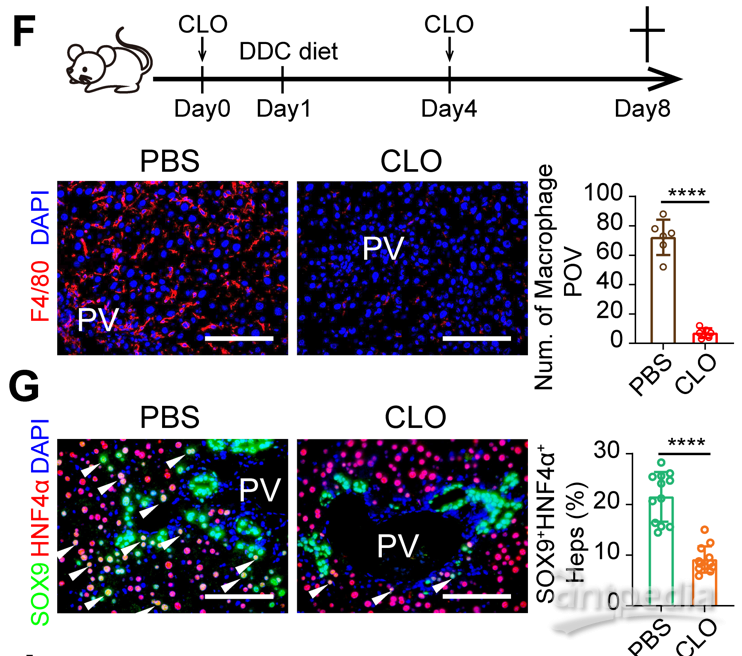
巨噬细胞清除影响肝细胞重编程发生
研究人员进一步对肝脏不同种类的免疫细胞进行了敲除,发现敲除巨噬细胞能够显著抑制LPLCs的出现,而敲除适应性免疫细胞以及NK细胞和粒细胞对LPLCs出现无明显作用。由于肝脏损伤下,巨噬细胞存在异质性,按照来源分主要分为两种,一种是胚胎发育时期来源的Kupffer细胞(KCs),另一种是损伤下招募的单核来源的巨噬细胞(MoMFs)。研究人员通过对巨噬细胞进行单细胞测序,解析了肝脏损伤下巨噬细胞的异质性,并利用巨噬细胞谱系特异性敲除的动物模型,发现KCs是LPLCs出现所必要的,而阻断MoMFs对LPLCs出现无影响。
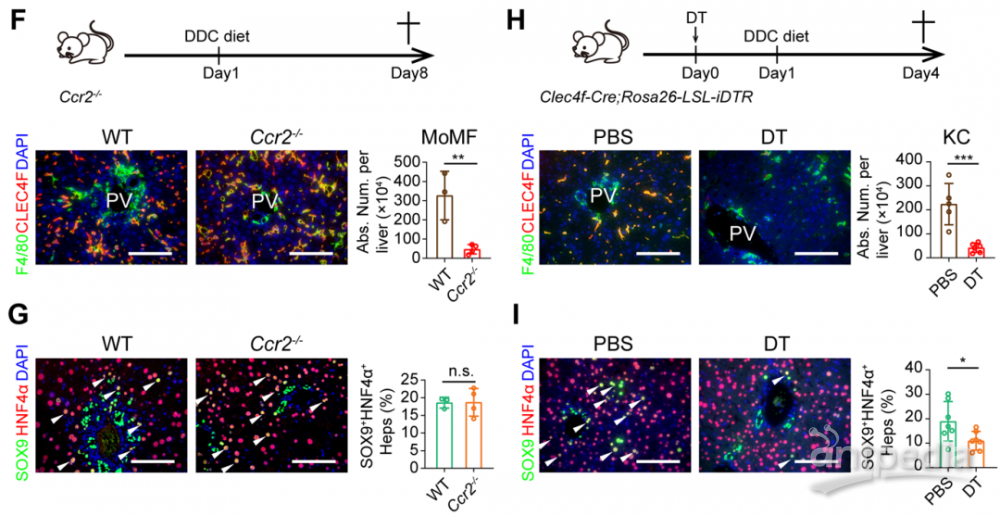
巨噬细胞亚群表达CLEC4F的Kupffer细胞贡献肝细胞重编程过程
为了研究KCs调控LPLCs出现的机制,研究人员对KCs特异分泌的因子进行体内过表达筛选,发现KC特异表达的IL-6可以在无损伤的肝脏内诱导LPLCs出现,具体机制是结合肝细胞IL6R/gp130受体,其下游是通过STAT3信号转导实现。
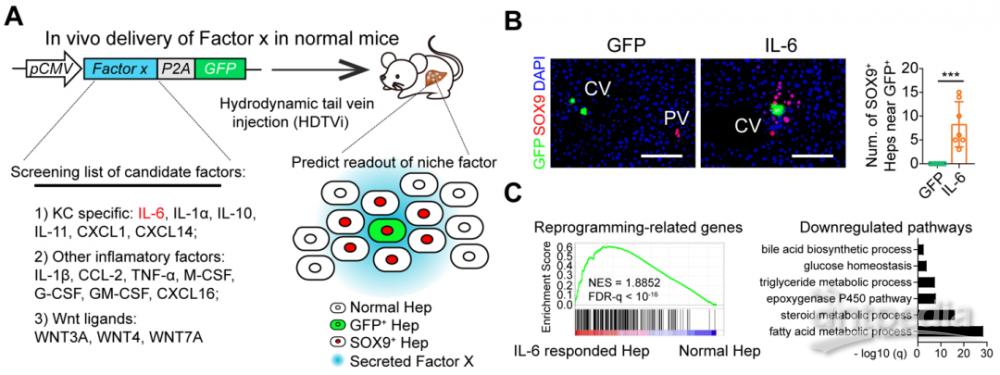
正常小鼠体内过表达筛选系统鉴定KCs表达的IL-6诱导肝细胞去分化
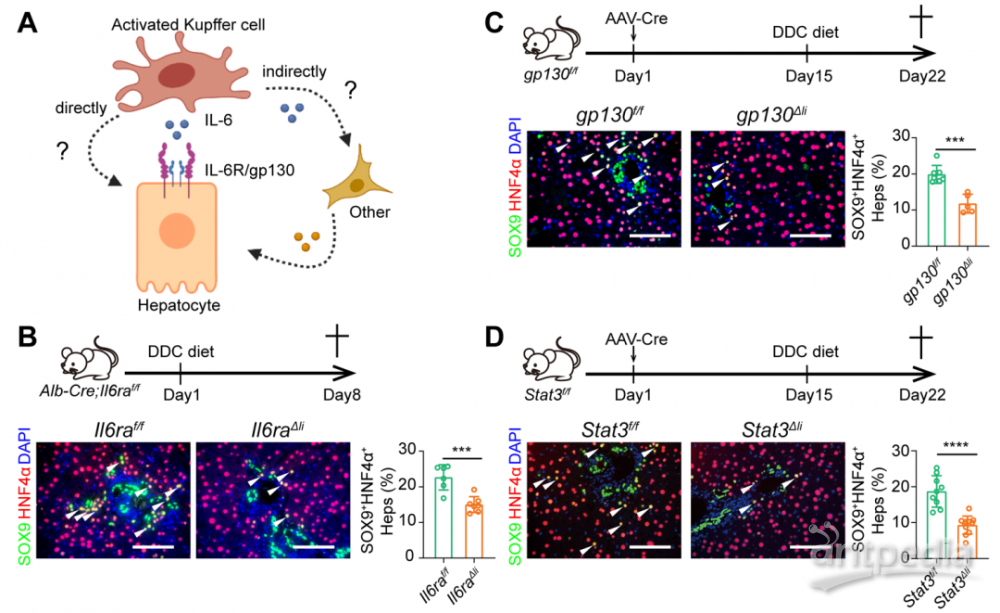
IL-6诱导肝细胞去分化通过直接结合受体IL6R/gp130激活STAT3实现
最后,为了研究STAT3调控重编程基因表达的分子机制,研究人员利用ChIP-seq技术证明了STAT3能够结合到重编程相关基因的位点。这些位点是受Arid1a调控并预先开放的染色质区域。这些位点同样具有更高的H3K27ac(增强子)的修饰,体内的报告系统实验也揭示STAT3能结合到增强子区域,促进下游基因的转录。由于LPLCs的特征基因也包含了胚胎发育时期基因,有趣的是,研究人员发现胚胎发育过程中STAT3并未激活,组蛋白H3K27ac修饰在LPLCs相关的增强子也未激活,说明了肝脏损伤下IL-6/STAT3信号是结合了损伤特异的增强子诱导了前体基因的表达。
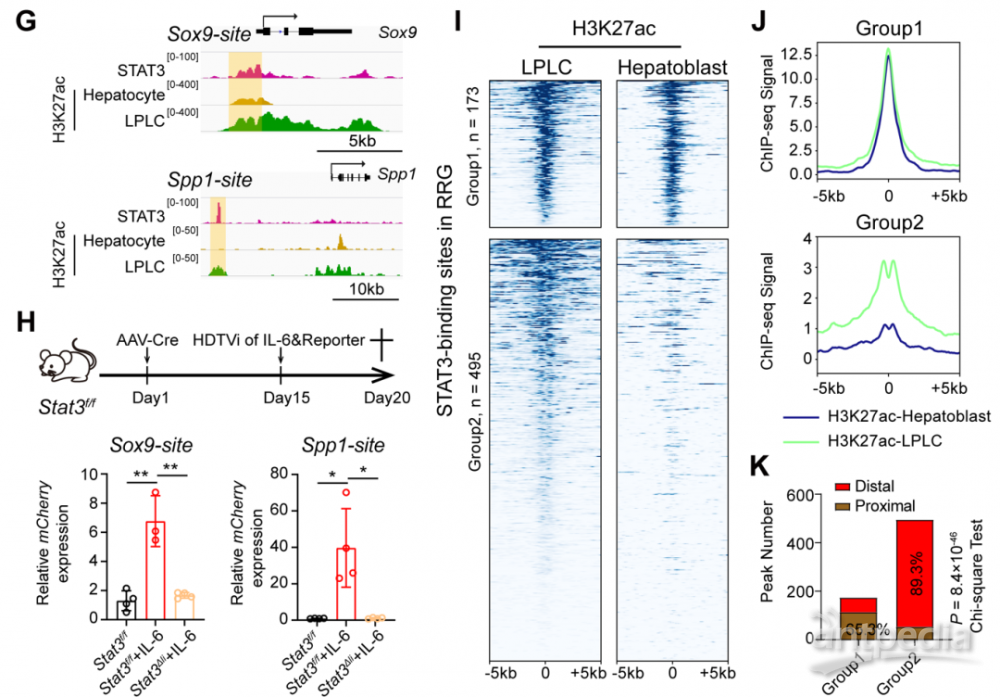
STAT3通过损伤特异的增强子诱导前体基因的表达
本研究揭示了肝脏损伤下巨噬细胞的炎症信号通过损伤特异的转录调控模式诱导肝细胞去分化的机制,该机制为探索诱导体内重编程的因子,开发治疗肝脏疾病相关药物,奠定了重要的理论基础。
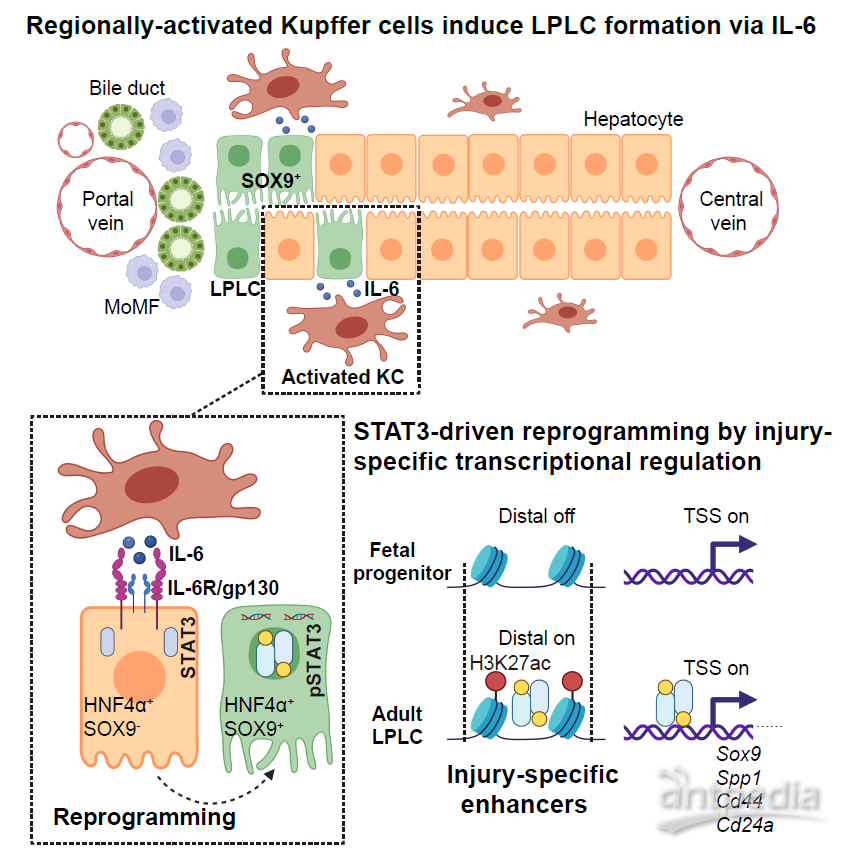
Kupffer细胞来源IL-6通过损伤特异增强子诱导肝细胞去分化机制
中国科学院分子细胞科学卓越创新中心博士李露(已毕业),在读博士崔磊和中国科学院上海营养与健康研究所博士后林平为该论文共同第一作者,惠利健研究员、李虹研究员和李亦学研究员为该论文通讯作者。该研究得到分子细胞科学卓越创新中心动物实验技术平台、细胞分析技术平台和分子生物学技术平台的大力支持。该工作得到中国科学院、基金委、科技部、上海市科委、上海市发改委等经费支持。







