细胞不贴壁、生长缓慢怎么解决?
在细胞培养过程中会出现这样或那样的问题,这些问题从细胞生长角度来说,针对细胞不贴壁、生长缓慢、生长不好,甚至死亡的原因,我们做以下分析并提出相对应的解决方法。
一、培养细胞不贴壁
可能原因:
•胰蛋白酶消化过度;
•支原体污染;
•培养基pH值过碱(NaHCO3分解);
•细胞老化;
•接种细胞起始浓度太低或太高。
解决方法:
•缩短胰蛋白酶消化时间或降低胰蛋白酶浓度;
•分离培养物,检测支原体。清洁支架或培养箱。如发现支原体污染,丢弃培养物;
•使用无菌醋酸溶液调整pH值或充入无菌CO2;
•启用新的保种细胞;
•调节最佳接种细胞浓度。
二、培养细胞生长缓慢
可能原因:
•由于更换不同培养液或血清;
•培养液中一些细胞生长必需成分如谷氨酰胺或生长因子耗尽或缺乏或已被破坏;
•培养物中有少量细菌或真菌污染;
•试剂保存不当;
•接种细胞起始浓度太低;
•细胞已老化;
•支原体污染 。
解决方法:
•比较新培养液与原培养液成分,比较新血清与旧血清支持细胞生长实验,让细胞逐渐适应新培养液;
•换入新鲜配置培养液,或补加谷氨酰胺及生长因子;
•用无抗生素培养液培养,如发现污染,丢弃培养物;
•血清需保存在-10到-20℃。培养液需在2-8℃避光保存。含血清完全培养液在2-8℃保存,需在1周内用完;
•增加接种细胞起始浓度;
•换用新的保种细胞;
•分离培养物,检测支原体。清洁支架和培养箱。如发现支原体污染,丢弃培养物。
三、培养细胞生长不好
可能原因:
•细胞本身的状态
细胞传代次数多,细胞老化;
细胞的接种量:接种量过低,细胞生长缓慢;
细胞传代时间过晚:细胞中毒,影响传代后的细胞生长;
胰酶消化时间过长或过短:时间过长,细胞死亡;时间过短,细胞未完全分离而成团,细胞死亡;
细胞的冻存与复苏:慢冻速融。
•污染
支原体污染;
霉菌污染。
•培养基或血清
更换血清或培养基之前未进行验证;
选择的培养基是否合适;
培养基配制是否准确无误。
•培养环境
CO2供应是否正常;
培养箱或摇床温度控制是否正确。
解决方法:
根据以上四个方面的可能原因,做出针对性的解决方案
•注意细胞的本身状态:如传代次数、接种量等;
•避免产生污染(用正规、合法、可溯源的血清);
•要用合适的血清或培养基,最好经过验证;
•注意实验室的环境。
四、培养细胞死亡
可能原因:
•培养箱内无CO2;
•培养箱内温度波动太大;
•细胞冻存或复苏过程中损伤;
•培养液渗透压不正确;
•培养液中有毒代谢产物堆积 。
解决方法:
•检测培养箱内CO2;
•检查培养箱内温度;
•取新的保存细胞种;
•检测培养液渗透压;
•换入新鲜培养液。
下面为您推荐Esco产品——CelCradle系列生物反应器—高密度细胞培养的最佳摇篮
一、什么是CelCradleTM生物反应器

CelCradleTM生物反应器根据潮汐涨落原理设计而成,其中波纹管的压缩和解压可使细胞不断接触培养基的营养与空气,提供了一个低细胞撕裂、无泡沫、高氧气饱和度以及高营养浓度的细胞培养环境。
CelCradleTM是用于高密度细胞培养的一款易于使用的经济型台式生物反应器,既可以高密度培养细胞,也可以收集细胞分泌产物。
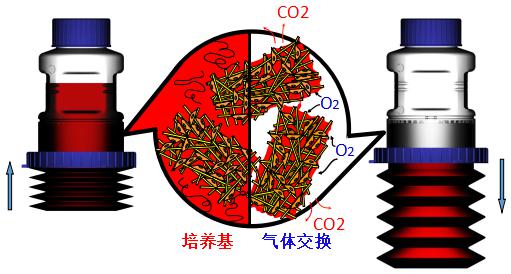
二、CelCradleTM潮汐式工作原理
通过CelCradleTM细胞培养瓶底部的波纹管压缩和解压,细胞间歇的暴露在空气和培养基中,使细胞充分与培养基和氧气接触,和滚瓶的原理类似。
三、CelCradleTM生物反应器产品特点
•大面积高密度贴壁细胞培养空间
•预先灭菌、随时可用
•一次性使用CelCradleTM培养瓶,操作简单
•低剪切力、低细胞撕裂、无泡沫以及无氧气限制高营养的细胞培养环境
•兼容大多数无血清培养基
•全细胞、细胞组分或细胞产物的培养和采集功能
四、为什么选择CelCradleTM生物反应器
1. 简便易用的设计,一次性使用可以节约空间和人力资源
CelCradleTM生物反应器是一款随时可用的一次性生物反应系统,无需启动时间及复杂的学习过程。
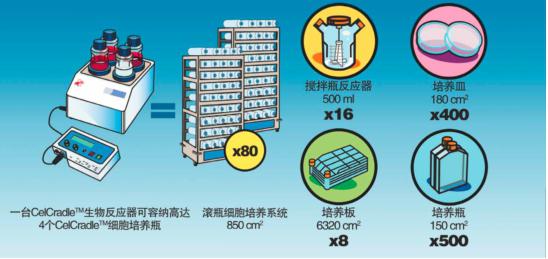
CelCradleTM生物反应器可放置在6立方英尺CO2培养箱内,并且可同时运行4个细胞培养瓶。 一个标准CelCradleTM细胞培养瓶带有5.5g BioNoc II载体,可提供15000平方厘米的细胞培养总面积,培养细胞数可达到4~5x109/瓶,相当于18至20个滚动式细胞培养瓶的培养量。
可以通过增加CelCradleTM培养瓶数或者使用同为潮汐原理的TideCellTM生物反应器实现细胞规模的扩大化生产,从而简化了培养系统规模扩大的过程以及节省了开发过程中所需的支出。
2. 高细胞产量,特殊的B_H功能促进蛋白表达
一台CelCradleTM生物反应器可取代数百个培养皿、传统细胞培养瓶以及多组细胞培养滚瓶等等,从而大大缩减生产成本。
该系统不仅可实现较高的细胞产量,且这种特殊的B_H功能(增加底部保持时间)不仅限制了细胞的过度生长而且增加了超过3倍的蛋白表达,同时还可实现更高的蛋白浓度并在培养过程中节省培养基。
五、应用领域
•哺乳动物和昆虫细胞培养
•蛋白质和病毒生产
•单克隆抗体生产
•蛋白质组研究
•药物研发
•药物代谢动力学研究
•基因和细胞治疗研究
专业论文支持
以下是一些现有支持CelCradleTM细胞培养系统的科学研究应用的学术论文
[1]Akiyama, M., Nakayama, D., Takeda, S., Kokame, K., Takagi, J., & Miyata, T. (n.d.). Crystal structure and enzymatic activity of an ADAMTS-13 mutant with the East Asian-specific P475S polymorphism. J Thromb Haemost Journal of Thrombosis and Haemostasis, 1399-1406.
[2]Asaoka, Y., Tanaka, T., Tsumoto, K., Tomita, M., & Ide, T. (n.d.). Efficient expression of recombinant soluble human FcγRI in mammalian cells and its characterization. Protein Expression and Purification, 155-161.
[3]Brown, A., Mcsharry, J., Adams, J., Kulawy, R., Barnard, R., Newhard, W., . . . Drusano, G. (2011). Pharmacodynamic Analysis of a Serine Protease Inhibitor, MK-4519, against Hepatitis C Virus Using a Novel In Vitro Pharmacodynamic System. Antimicrobial Agents and Chemotherapy, 1170-1181.
[4]Chen, Y., Wu, J., Wang, K., Chiang, Y., Lai, C., Chung, Y., & Hu, Y. (n.d.). Baculovirus-mediated production of HDV-like particles in BHK cells using a novel oscillating bioreactor. Journal of Biotechnology, 135-147.
[5]Drugmand, J., J.-F., J., Agathos, S., & Schneider, Y. (n.d.). Growth of Mammalian and Lepidopteran Cells on BioNOC® II Disks, a Novel Macroporous Microcarrier. Cell Technology for Cell Products, 781-784.
[6]Hammonds, J., Chen, X., Zhang, X., Lee, F., & Spearman, P. (n.d.). Advances in methods for the production, purification, and characterization of HIV-1 Gag–Env pseudovirion vaccines. Vaccine, 8036-8048.
[7]Haredy, A., Takenaka, N., Yamada, H., Sakoda, Y., Okamatsu, M., Yamamoto, N., . . . Okamoto, S. (2013). An MDCK Cell Culture-Derived Formalin-Inactivated Influenza Virus Whole-Virion Vaccine from an Influenza Virus Library Confers Cross-Protective Immunity by Intranasal Administration in Mice. Clinical and Vaccine Immunology, 998-1007.
[8]Haredy, A., Yamada, H., Sakoda, Y., Okamatsu, M., Yamamoto, N., Omasa, T., . . . Yamanishi, K. (2014). Neuraminidase gene homology contributes to the protective activity of influenza vaccines prepared from the influenza virus library. Journal of General Virology, 2365-2371.
[9]Ho, L., Greene, C., Schmidt, A., & Huang, L. (n.d.). Cultivation of HEK 293 cell line and production of a member of the superfamily of G-protein coupled receptors for drug discovery applications using a highly efficient novel bioreactor. Cytotechnology, 117-123.
[10]Hu, Y., Lu, J., & Chung, Y. (n.d.). High-density cultivation of insect cells and production of recombinant baculovirus using a novel oscillating bioreactor. Cytotechnology, 145-153.