顾臻团队首创冻干组织递药技术,赋能CAR-T治疗实体瘤
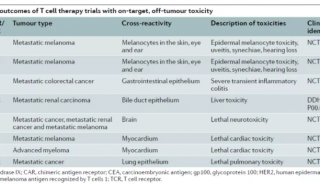
CAR-T细胞疗法(嵌合抗原受体T细胞疗法)在治疗B细胞淋巴瘤方面表现出了卓越疗效。然而,CAR-T细胞疗法对占据癌症绝大多数的实体瘤的效果仍然差强人意。许多挑战阻碍了CAR-T细胞疗法在实体瘤中的活性,包括实体瘤致密的细胞外基质导致T细胞浸润不良,以及抑制性肿瘤微环境导致T细胞无反应和衰竭。目前,有一些研究通过控制T细胞释放、模拟淋巴结内T细胞激活信号或通过合成抗原呈递细胞和CAR-T细胞的局部扩增等方法,设计出了增强CAR-T细胞疗法的方法。
淋巴结(Lymph nodes,LNs)是适应性免疫系统的关键器官,负责T细胞的启动、激活和耐受。T细胞的活性和功能高度受淋巴结的调节,其独特的结构包含不同的细胞,共同检测和响应病原体来源的抗原。2024年3月6日,浙江大学药学院顾臻教授、李洪军研究员、浙江大学医学院附属第一医院赵鹏主任医师等在 Nature Materials 期刊发表了题为:Lyophilized lymph nodes for improved delivery of chimeric antigen receptor T cells 的研究论文。
该研究在国际上首次提出了用冷冻干燥技术冻干的淋巴结来装载CAR-T细胞的新策略,提高对实体瘤的递送,并抑制手术后的肿瘤复发。这种组织介导细胞释放的组织递药策略,有望实现多种细胞和治疗药物的受控释放,具有长期活性和增强功能。

淋巴结提供了一个专门的结构,支持T淋巴细胞和B淋巴细胞的平衡。免疫细胞的相互作用和运输在淋巴结中有序地进行。血液中的重要营养素和生长因子通过高内皮细胞微静脉(HEV)进入淋巴结,而成纤维细胞网状细胞和其他基质细胞分泌的趋化因子增强细胞的招募和生存。在原发性肿瘤的解剖过程中,通常会摘除区域淋巴结,以提供预后信息并识别结节转移。因此,淋巴结也可以用来生成一种生物相容的自体材料来递送治疗药物,包括CAR-T细胞。
在这项研究中,研究团队开发了一种通过冻干的患者来源的淋巴结来递送CAR-T细胞以抑制术后肿瘤复发的新策略。冻干淋巴结(L-LNs)可以形成T细胞大小的隔室来容纳CAR-T细胞,同时保持基质框架和细胞因子和趋化因子的内容物,这些都是CAR-T细胞生存和扩增的关键。
研究团队指出,自体组织中获取淋巴结可避免移植排异反应,将其冻干并装载CAR-T细胞(CAR T@L-LNs)后植入肿瘤部位,冻干淋巴结和CAR-T细胞整合的过程仅需数小时,柔韧的CAR-T@L-LNs可以在超声引导下通过肿瘤旁的留置导管导入术后切除部位(这是大多数手术中常用的术后引流方法)。此外,在肿瘤切除手术之前,还可以通过微创手术获得淋巴结。
该研究显示,CAR-T细胞可以有效地装载到冻干淋巴结中,其未改变的网状结构和细胞因子和趋化因子含量促进了CAR-T细胞的存活和激活。