未来可期-CAR-T细胞疗法的发展及展望(一)
引言:
嵌合抗原受体T细胞疗法(CAR-T)是近年来发展非常迅速的一种新型细胞免疫治疗技术,CAR-T免疫疗法是通过给T细胞装备能识别特定肿瘤细胞的分子,在识别肿瘤细胞后能引起T细胞的激活和增殖,从而可以有效杀伤肿瘤细胞。2017年,FDA批准两个CAR-T产品上市,一个是诺华的Kymriah(Tisagenlecleucel,CTL019),被批准其用于治疗3~25岁的儿童和年轻成人急性淋巴细胞白血病(ALL),开启了恶性血液肿瘤免疫治疗的新篇章。另一个获批的是Kite
Pharma 的Yescarta (Axicabtagene
Ciloleucel,KTE-C19),用于治疗成人复发或难治性大B细胞淋巴瘤,这是第一个用于治疗非霍奇金淋巴瘤的CAR-T产品。由于Kymriah
和Yescarta
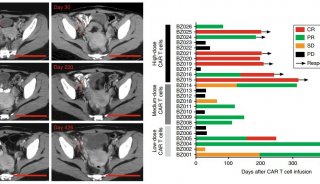
的受试者中有部分出现了严重的细胞因子释放综合征(CRS)及神经毒性,严重时可危及生命。因此,正确有效地对CRS进行管理和干预,降低CAR-T治疗过程中不良事件发生率是临床上亟须解决的问题。本文将就CAR-T发展、CAR-T在实体瘤中的应用、CAR-T面临的挑战以及未来发展方向做一阐述。
1.CAR-T细胞疗法的原理及发展
T细胞的活化主要通过双信号通路完成。第一信号是抗原特异性信号,由T细胞表面受体(TCR)与抗原肽-主要组织相容性复合物(MHC)的特异性结合构成;第二信号是抗原非特异性信号,它由T细胞与抗原递呈细胞(APC)表面的共刺激分子(CM)相互作用来介导。这两种信号的共同参与了T细胞的活化,诱导T细胞产生级联反应,最终使T细胞可以活化为细胞毒性T淋巴细胞(CTL)。当CTL与患者体内含有相同抗原肽-MHC分子复合物的肿瘤细胞相遇后,二者特异性结合,刺激CTL产生释放裂解肿瘤细胞的穿孔素、颗粒酶,直接杀死肿瘤细胞;或者释放细胞因子,改变肿瘤细胞生存环境,抑制肿瘤细胞的生长,也可通过CTL表面表达的FasL与肿瘤细胞表面的Fas结合,诱导肿瘤细胞凋亡[1]。然而,肿瘤患者体内的T细胞在肿瘤微环境的影响下,T细胞活化受阻,或者T细胞不能识别肿瘤细胞的抗原肽,这就导致了T细胞杀伤作用不足以清除肿瘤细胞,因此通过在体外改造T细胞,使其成为能识别并杀伤肿瘤的细胞,这一想法即是CAR-T的来源。

图1:T细胞活化双信号
CAR-T细胞疗法治疗的原理是通过基因工程技术将识别肿瘤相关抗原(Tumor associated antigen,TAA) 的抗体可变区基因序列与胞内信号区序列在体外进行重组(形成CAR),再通过病毒转染方式将编码CAR基因的重组质粒在体外转进已分离出的患者T淋巴细胞中,使T细胞表面表达能识别肿瘤抗原的受体蛋白,经体外大规模培养扩增后表达特异性嵌合抗原受体的T细胞称为CAR-T细胞[2]。由于治疗使用的T细胞来源于患者的外周血细胞,整个治疗过程没有免疫排斥反应。当大量CAR-T细胞回输到患者体内后,CAR能特异性地识别靶向肿瘤细胞的抗原,活化后的T细胞可以杀伤肿瘤细胞,从而达到治疗肿瘤的目的。
根据CAR的胞内结构域,对CAR的设计研究已经进行到了第五代[3]。初代CAR设计相对简单,由单链抗体通过跨膜区域与细胞内信号传导区免疫受体酪氨酸激活基序(ITAM,Immunoreceptor tyrosine-based activation motif)相连,ITAM通 常为CD3ζ或FcεRIγ,第一代CAR设计的信号域是单一的信号分子,而肿瘤细胞表面共刺激分子表达减弱或者缺失,因此CAR修饰的T细胞缺乏共刺激-第二信号的支持,T细胞激活后很快由于信号限制而丧失作用,这使得第一代CAR-T细胞在患者体内抗肿瘤效果有限[4]。作为改进,二代CAR在前一代的基础上引入了一个共刺激分子(如CD28,4-1BB,OX40等),用来激活第二信号,提供双重活化信号从而加强CAR-T细胞对肿瘤细胞的杀伤毒性,这明显的改善了第一代CAR对T细胞激活不充分的缺点[5, 6];三代CAR则在二代的基础上引入多个共刺激分子(如CD28、CD137、OX40等),多种共刺激分子相互组合可以增强T细胞内的JNK、NK-kB等信号通路,使得T细胞表现出更强更持久的作用活性,这对增加T细胞的抗肿瘤活性、延长T细胞的增殖能力、生存周期及促进细胞因子(如IL-2、IFN-γ、TNF-α等)的分泌等方面均有显著的提升。但临床上第三代CAR研究较少,且三代CAR会造成T细胞刺激阈值降低,可能引起活化信号的泄露,从而诱发细胞因子释放过量,因此具体作用是否比二代CAR效果好还需要进一步研究[7]。四代CAR属于新型研究,相比三代CAR其整合了一个活化T细胞核因子转录相应元件,它可以使CAR-T细胞在肿瘤区域分泌特定的细胞因子(例如IL-12),从而可以提高了T细胞在肿瘤微环境中的存活率,招募并活化其它免疫细胞进入肿瘤微环境中进行免疫应答[8]。五代CAR-T就是通用型CAR-T,它以基因编辑技术为基础,设计可以阻止人体发生排异反应的基因,并且可以进行异体T细胞的提前制备,随时提供给患者。但就临床应用来看,第二代CAR-T细胞疗法仍为主流。图2为CAR发展历程图。

图2:CAR的发展历程
2.CAR-T在实体瘤中的应用
相比于血液系统肿瘤,实体瘤中CAR-T的应用受到更多因素的限制,一方面,实体瘤发生部位不像血液系统散布全身,CAR-T细胞需抵达实体瘤病灶,并浸润到肿瘤内部,即使CAR-T细胞能够浸润到实体瘤内部,也会面临其内部免疫微环境的抑制,影响T细胞正常发挥作用;另一方面,实体瘤内部微环境存在偏酸、缺氧及营养缺乏等情况,也不利于CAR-T细胞发挥作用。此外,实体肿瘤缺乏较理想的特异性表面抗原,且具有不同的免疫抑制机制,因此CAR-T细胞免疫治疗在实体瘤的疗效不及血液肿瘤(特别是B细胞恶性肿瘤),但其在神经母细胞瘤、非神经母细胞瘤、肉瘤、间皮瘤、胰腺癌等肿瘤中取得了较好的疗效。由June博士领导的小组在临床实验中,通过靶向间皮素(Mesothelin)的CAR
mRNA瞬转入病人T细胞中,回输CAR-T细胞后,发现1例胰腺癌转移的晚期病人和1例晚期间皮瘤病人,均获得显著治疗效果,没有任何脱靶毒性发生[9]。HER2基因是受体酪氨酸蛋白激酶家族的成员,在很多肿瘤细胞过表达并且在上皮细胞上也有表达,在临床实验中,已经采用第二代CAR-T靶向HER2来治疗表达HER2的肿瘤患者[10]。另外,由于肿瘤新生血管与肿瘤的生长转移密切相关,应用靶向新生血管中过表达的血管内皮生长因子受体2(VEGFR-2)的CAR-T细胞进行肿瘤免疫治疗,能够抑制小鼠不同的肿瘤生长,且对正常组织无明显损伤,进而可以发挥间接抗肿瘤作用[11,
12]。
3.CAR-T 细胞疗法面临的挑战
CAR-T细胞在肿瘤免疫治疗方面拥有很多优势,它可以利用非限制性的形式特异识别和杀伤表达特定抗原的癌细胞,以单链抗体(single
chain antibody
fragment,scFv)作为抗原识别区段的CAR能够识别不同种类的抗原,包括糖类和脂类等非蛋白抗原,肿瘤表面的脂类抗原也可以作为靶点,而不再仅局限于蛋白类抗原。这扩大了肿瘤抗原靶点范围。此外,CAR-T细胞还可以分泌多种细胞因子实现其在体内的持续增殖,对肿瘤细胞有特异识别杀伤作用,同时,这些细胞因子还可以改变肿瘤免疫微环境对免疫细胞的抑制作用。尽管有着诸多优势,然而,新疗法不可避免的会产生一些新问题,特别是在治疗过程出现的严重毒副作用,其中以细胞因子释放综合征(CRS)最频繁、症状最突出。另外,脱靶效应、神经毒性以及插入突变都会影响CAR-T的最终疗效。