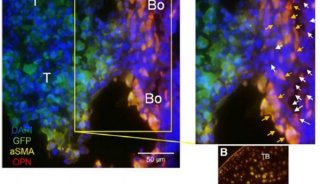
天津医大教授癌症研究连发3权威期刊
天津医科大学肿瘤医院肿瘤研究所的博士生导师冯玉梅(Yu-Mei Feng)教授,研究方向为肿瘤分子生物学,多年来致力于乳腺癌转移基因筛选、转移预后预测及转移机制研究。在2015年上半年,她带领的研究小组先后在国际知名期刊《Breast Cancer Research》(影响因子5.88)、《Cancer Research》(影响因子9.28)和《Journal of Biological Chemistry》(影响因子4.6)发表乳腺癌研究相关成果。
2015年二月份,该研究小组在《Breast Cancer Research》发表题为“FOXF2 deficiency promotes epithelial-mesenchymal transition and metastasis of basal-like breast cancer”的学术论文。之前他们开展的一项临床研究表明,FOXF2的低表达与三阴性乳腺癌患者的早期转移和不良预后有关。基于此,在这项研究中,研究人员进一步描述了FOXF2在基底样乳腺癌转移中的作用以及根本分子机制。
通过RT-qPCR、免疫印迹、免疫荧光检验和免疫组织化学等实验手段,研究人员发现,FOXF2在大多数基底样乳腺癌细胞中是特异性表达的。FOXF2缺乏可在体内外增强基底样乳腺癌细胞的转移能力。此外,FOXF2缺乏可诱导基底样乳腺癌的上皮间质转化(EMT)。而且,该研究发现,TWIST1是FOXF2的一个转录靶标。TWIST1是由FOXF2负调控的,并介导FOXF2调控的基底样乳腺癌EMT表型,以及基底样乳腺癌的侵袭特性。
根据这些结果,研究认为,FOXF2是基底样乳腺癌细胞中一种新型的EMT抑制转录因子。FOXF2缺乏可通过上调TWIST1的转录激活EMT程序,增强基底样乳腺癌细胞的转移能力。
六月九日,冯玉梅教授课题组在国际知名癌症期刊《Cancer Research》发表题为“ITGBL1 is a Runx2 Transcriptional Target and Promotes Breast Cancer Bone Metastasis by Activating the TGF-β Signaling Pathway”的学术文章。在这篇新文章中,研究人员提供了临床和实验证据,阐明了ITGBL1是乳腺癌骨转移的一个关键促进因子。在体内模型系统和体外实验中,ITGBL1表达促进了骨拟态(osteomimetic)改变乳腺癌形成,促进了癌细胞招募、定居到骨微环境中生长,以及破骨细胞成熟造成骨溶解性病损。
进一步的机制研究,将TGF-β信号通路确定为ITGBL1的下游效应器,而转录因子Runx2则是ITGBL1表达的上游激活子。为了支持这些研究发现,他们还证实了ITGBL1是Runx2诱导乳腺癌骨转移的一个必不可少的介质。总之,这项新研究揭示出了乳腺癌骨转移的一个新分子机制,并提供了一些功能证据,为鉴别晚期乳腺癌的风险及防治这一疾病指出了一些新的候选生物标记物和治疗靶点。
六月十二日,冯玉梅教授带领的课题组又在国际知名学术期刊《Journal of Biological Chemistry》发表一项研究成果,题为“DNA Methylation Affects the SP1-Regulated Transcription of Forkhead Box F2 in Breast Cancer Cells”,描述了FOXF2在乳腺癌中亚型特异性表达的一种新调控机制。
该研究小组在之前的研究中发现,FOXF2在基底样乳腺癌细胞中特异性表达,起着EMT抑制因子的作用。FOXF2缺乏可通过激活EMT程序、但降低细胞增殖,而增强基底样乳腺癌细胞的转移能力。目前这项研究表明,FOXF2邻近启动子区的CpG岛甲基化,参与了FOXF2在乳腺癌细胞中亚型特异性表达的调控机制。DNMT1、DNMT3A和DNMT3B共同或单独地促进了不同乳腺癌细胞中的这种DNA甲基化。SP1可通过直接与邻近启动子区结合,而调控FOXF2的转录活性,但这种结合可通过DNA甲基化而被解除。FOXF2可介导SP1,对非甲基化基底样乳腺癌细胞增殖进程起着抑制或促进作用。
因此,本研究认为,乳腺癌细胞中的亚型特异性表达和FOXF2功能,是通过DNA甲基化与SP1转录调控的联合效应而被调控的。
-
科技前沿

-
科技前沿

-
项目成果
-
项目成果
-
项目成果
-
项目成果
-
项目成果