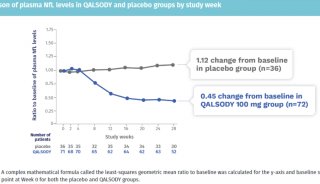
2020上半年中国药品优先审评 这15款创新药备受期待!
根据中国国家药监局药品审评中心(CDE)网站公示信息,截止6月30日,上半年共计有107项(按受理号统计)上市申请被正式纳入优先审评,包括57项新药上市申请和50项仿制药上市申请。
在创新药方面,除了已获批的药物,目前还有50项新药上市申请正在审评审批中,涉及35款药物。从纳入优先审评理由来看,其中有16款为具有明显治疗优势的创新药,14款为罕见病、儿童药品,4款为艾滋病药品,还有1款因临床急需短缺等原因被纳入。本文节选备受期待的,有望通过优先审评获批上市的15款创新药,与读者分享。
1、辉瑞:伊珠单抗奥唑米星
纳入优先审评理由:具有明显治疗优势创新药
Besponsa(伊珠单抗奥唑米星)是辉瑞(Pfizer)公司开发的一款创新抗体药物偶联物(ADC),由靶向CD22的单克隆抗体和细胞毒剂卡奇霉素两部分组成。由于CD22抗原在B细胞表面普遍存在,Besponsa能够通过靶向癌细胞,与其表面的CD22抗原结合,并在随后被内吞入癌细胞。进入癌细胞后,卡奇霉素会发挥它的功效,造成癌细胞的死亡。
Besponsa已在美国获批治疗B细胞前体急性淋巴细胞白血病。在中国,辉瑞于2020年1月提交了注射用伊珠单抗奥唑米星的上市申请,适应症为复发性或难治性CD22阳性的急性淋巴细胞白血病(ALL)。
2、罗氏:risdiplam口服溶液用粉末
纳入优先审评理由:临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药
Risdiplam(RG7916)是罗氏(Roche)旗下一款口服SMN2基因剪接调节剂,可通过调节SMN2基因的mRNA剪接过程,提高SMN蛋白在中枢神经系统和外周的表达。据悉,risdiplam可用于治疗所有类型(1型、2型、3型)脊髓性肌萎缩症(SMA)的婴幼儿、儿童、成人患者。目前,它正在多项临床试验中治疗0至60岁不等的SMA患者。
在美国,FDA已授予risdiplam孤儿药资格和快速通道资格,有望于今年第三季度获FDA批准。若顺利获批,它不仅有望成为全球第三款用于治疗SMA的药物,而且也有望成为治疗所有3种类型SMA的首个口服药物。
3、罗氏:阿替利珠单抗
纳入优先审评理由:具有明显治疗优势创新药
阿替利珠单抗(atezolizumab)是罗氏旗下基因泰克(Genentech)公司开发的抗PD-L1单抗。该药物通过和肿瘤细胞表面以及肿瘤浸润免疫细胞表面的PD-L1蛋白结合,不但可以阻碍PD-L1与PD-1受体的结合,还可以阻止PD-L1和B7.1受体结合,既帮助人体免疫系统识别肿瘤细胞,又可以进一步激活人体免疫系统T细胞攻击肿瘤细胞。
在中国,阿替利珠单抗已于今年2月获批联合化疗用于一线治疗广泛期的小细胞肺癌。目前被纳入优先审评的是该药在中国的第2个上市申请,据悉该适应症为一线治疗晚期肝细胞癌。
4、阿斯利康:达格列净片
纳入优先审评理由:针对特定心力衰竭成人患者、作用于新靶点
达格列净片是阿斯利康(AstraZeneca)开发的一款“first-in-class”口服钠-葡萄糖共转运蛋白2(SGLT2)抑制剂。SGLT2是肾脏内协助葡萄糖重吸收的转运蛋白。SGLT2抑制剂通过抑制SGLT2的功能,让更多葡萄糖从尿液中排走,从而降低血液中的葡萄糖水平。
在中国,达格列净于2017年首次获批上市,用于2型糖尿病成人患者改善血糖控制,是首个在中国上市的SGLT2抑制剂。本次的上市申请针对的是一项新适应症,用于射血分数降低的心力衰竭(HFrEF)成人患者,降低心血管死亡和心力衰竭恶化的风险,并改善心力衰竭症状。值得一提的是,这一适应症在今年5月初刚获得美国FDA批准。
5、葛兰素史克:注射用贝利尤单抗
纳入优先审评理由:儿童用药
贝利尤单抗是葛兰素史克(GSK)旗下一种重组的完全人源化IgG2λ单克隆抗体,通过抑制B细胞的增殖及分化,诱导自身反应性B细胞凋亡,从而减少血清中的自身抗体,达到治疗系统性红斑狼疮的目的。早在2011年3月,贝利尤单抗(海外商品名:Benlysta)就得到了美国FDA的批准。至2019年4月,该药物再次获得FDA批准,用于治疗患有系统性红斑狼疮(SLE)的儿童患者,成为FDA批准的首款能够治疗儿童红斑狼疮患者的创新疗法。贝利尤单抗纳入优先审评意味着,儿童红斑狼疮首款创新疗法有望加速在中国获批上市。
6、艾伯维:维奈克拉片
纳入优先审评理由:具有明显治疗优势创新药
维奈克拉片(venetoclax)是一款全球首创的口服、选择性B细胞淋巴瘤因子-2(BCL-2)抑制剂,可选择性抑制BCL-2功能,重塑细胞的关键信号通路,让癌细胞自我毁灭,达到治疗肿瘤的目的。该药已在美国获批治疗慢性淋巴性白血病、急性骨髓性白血病等多种适应症,是首个获得美国FDA批准上市的BCL-2抑制剂,曾多次被美国FDA授予突破性疗法认定。
7、拜耳医药:ODM-201
纳入优先审评理由:具有明显治疗优势创新药
ODM-201(darolutamide)是拜耳(Bayer)和Orion公司联合开发的一种新型口服雄激素受体(AR)抑制剂。研究表明,该药物抑制受体功能和前列腺癌细胞的生长,而且血脑屏障透过率低,对GABAA受体的亲和力也更低,不良反应更少。2019年7月,该药物获得FDA批准,用于治疗非转移性去势抵抗性前列腺癌患者。一项多中心临床研究结果表明,darolutamide联合雄激素剥夺疗法(ADT)较安慰剂联合ADT组能显著延长患者无转移生存时间(40.4 vs. 18.4个月)。
8、诺诚健华:奥布替尼片
纳入优先审评理由:具有明显治疗优势创新药
奥布替尼是诺诚健华开发的一款BTK(布鲁顿氏酪氨酸激酶)抑制剂,可选择性地阻断BTK激酶活性、通过调节信号通路干预B细胞发育,从而控制各种B细胞恶性肿瘤的致癌进展。诺诚健华分别在去年11月、今年3月提交了奥布替尼治疗复发/难治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者、以及治疗复发/难治性套细胞淋巴瘤患者的上市申请,这两个申请均在今年上半年被纳入优先审评。
9、复星凯特:益基利仑赛注射液
纳入优先审评理由:具有明显治疗优势药品
益基利仑赛注射液(代号:FKC876)是复星凯特于2017年从吉利德科学旗下公司Kite Pharma引进Yescarta(Axicabtagene Ciloleucel)技术、并获授权在中国进行本地化生产的靶向CD19的自体CAR-T细胞治疗产品。CAR-T免疫细胞治疗是通过基因工程修饰患者自体T细胞,以表达靶向肿瘤抗原的嵌合抗原受体分子,由激活的T细胞介导杀伤肿瘤细胞。
Yescarta已在美国和欧洲获批上市。本次在中国,益基利仑赛申请的适应症为治疗二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者,包括弥漫性大B细胞淋巴瘤(DLBCL),非特指型、原发性纵隔B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的DLBCL。
10、渤健:富马酸二甲酯肠溶胶囊
纳入优先审评理由:罕见病药品
Tecfidera(富马酸二甲酯)是一种NF-kappaB(NFKB)的激活抑制剂,是全球上市的第3款口服多发性硬化症药物。目前,尚不清楚Tecfidera的确切作用机制,不过有研究认为它可能具有抗氧化特性,可以调节免疫反应、减少炎症,保护大脑和脊髓免受损伤。值得一提的是,Tecfidera也是Biogen旗下的当家产品,2019年在全球创造了高达44.33亿美元的销售额。
11、再鼎医药:甲苯磺酸奥玛环素
纳入优先审评理由:具有明显治疗优势创新药
甲苯磺酸奥玛环素(NUZYRA,omadacycline)是一种新型四环素,其设计旨在克服四环素耐药性,并具有广谱抗菌活性,包括革兰阳性菌、革兰阴性菌、非典型病原体和多种耐药菌株。该药最初由再鼎医药的合作伙伴Paratek Pharmaceuticals进行开发,再鼎医药于2017年获得了该药在大中华地区(包括中国大陆、香港、澳门及台湾)的独家开发和商业推广许可。
NUZYRA于2019年2月在美国上市,作为每日一次的口服和静脉注射抗生素用于治疗罹患社区获得性细菌性肺炎(CABP)及急性细菌性皮肤和皮肤结构感染(ABSSSI)的成人。本次在中国,甲苯磺酸奥玛环素申请上市的适应症也是CABP和ABSSSI。
12、葛兰素史克:多替拉韦拉米夫定片
纳入优先审评理由:具有明显治疗优势药品
Dovato(多替拉韦/拉米夫定片)是葛兰素史克开发的一种艾滋病鸡尾酒疗法。其中,多替拉韦钠片是一种HIV整合酶抑制剂,能够阻止HIV病毒进入细胞,已于2015年在中国获批联合其它抗逆转录病毒药物治疗人类HIV感染的成人和年满12岁的儿童患者。拉米夫定是一种核苷类逆转录酶抑制剂,通过阻断HIV逆转录酶和乙型肝炎病毒聚合酶发挥作用。
Dovato已于2019年在美国和欧盟获批上市。该药在美国获批的适应症为无逆转录病毒治疗史且对Dovato中任一组分均无已知耐药性的HIV-1成人感染者,这是FDA批准的首个完整的、每日一次的单一片剂二药方案。
13、默沙东:多拉韦林片、多拉韦林拉米夫定替诺福韦片
纳入优先审评理由:艾滋病药品
多拉韦林片(doravirine)是由默沙东(MSD)公司开发的一种每日一次的口服创新非核苷逆转录酶抑制剂。它通过与HIV-1病毒的逆转录酶结合,防止HIV-1病毒将RNA转化为DNA,从而阻断HIV-1病毒复制。多拉韦林/拉米夫定/替诺福韦片是一种复方制剂。这两种药物均已在美国获批用于治疗未接受过抗病毒疗法的成年HIV-1感染患者。
14、迈兰制药:依非韦伦/拉米夫定/替诺福韦片
纳入优先审评理由:艾滋病药品
依非韦伦(efavirenz)/拉米夫定(lamivudine)/替诺福韦(tenofovir disoproxil fumarate)片是迈兰制药公司开发的一款三联组合疗法,主要用于艾滋病的治疗,由迈兰在中国的子公司美信美达医药申报上市。
在美国,FDA已批准该三联组合疗法的两个治疗方案获批上市:一款为SymfiLo(依非韦伦400mg/拉米夫定300mg/富马酸替诺福韦二吡呋酯300mg)片剂,获批治疗体重至少35公斤的成人和儿童HIV-1感染者;另一款为每日一次单片剂方案Symfi(依非韦伦600mg/拉米夫定300mg/富马酸替诺福韦二吡呋酯300mg),获批治疗体重至少40公斤的成人和儿童HIV-1感染者。
除了上述药物,还有许多创新药也在上半年被纳入了优先审评,包括优时比的左乙拉西坦注射用浓溶液、安斯泰来(Astellas)的他克莫司、盟科医药的康泰唑胺等等。