一种免疫隔离装置,用于胰岛细胞的递送
I型糖尿病是一种自体免疫性疾病,患者自体的免疫细胞攻击胰岛中分泌胰岛素的β细胞,导致胰岛素分泌不足、血糖失控。临床上,从2-3个供体中分离出数以万计的胰岛,经过肝门静脉注入体内,患者从而能维持血糖稳态3-5年,并且摆脱外源性胰岛素的注射。然而即时血液介导的炎症反应、免疫抑制剂的副作用和供体胰岛细胞的短缺,导致了该治疗方案无法得到广泛的临床应用。近年来,通过干细胞分化技术可以获得源源不断的胰岛细胞,从根本上解决供体不足的问题,极具应用潜力。然而如何摆脱免疫抑制剂的使用,以及未分化干细胞的成瘤问题,仍需得到解决。
细胞封装技术是将外源细胞装载在具有免疫隔离屏障的器件、材料中,通常是具有一定孔径的半透膜,允许包括氧气和葡萄糖之类的小分子自由进出,同时能防止外源细胞被宿主免疫细胞攻击,从而无需使用免疫抑制剂。免疫隔离装置主要分为微包囊和大包囊装置。微包囊装置研究最多的是水凝胶,然而水凝胶通常力学性能较弱,移植体内受外力作用容易被破坏,免疫保护作用便会失效。大包囊与微包囊相比通常具有更好的力学性质,然而大包囊由于单位体积较大,比表面积相对微包囊更小,导致装置中的营养和代谢废物的进出交换相对微包囊较差,因而大包囊装置对于材料生物相容性有更高的要求,否则异物反应引起的纤维层会影响装置中细胞或组织的生存状态和生理功能。目前,有多款免疫隔离装置在临床试验中取得了一定的进展,然而还没有一个能同时兼顾安全性和功能性。
6月2日,美国康奈尔大学马明林教授团队在Science Translational Medicine期刊上发表了题为A nanofibrous encapsulation device for safe delivery of insulin-producing cells to treat type 1 diabetes的研究论文。该研究设计开发了一种既安全又有功能的免疫隔离装置,用于胰岛细胞(包括人干细胞来源的胰岛细胞)的递送,在实验小鼠中实现了对胰岛细胞的长期保护、维持了胰岛细胞的功能和存活,并且控制了血糖的稳态。

具体来说,该装置的设计考虑了以下几个方面:1)较强的力学性质以确保装置在体内长期稳定和安全;2)管状结构以实现高比表面积和便于微创手术移植及取回;3)良好的生物相容性避免纤维化的产生;4)精确控制的孔径确保把免疫细胞隔离在外的同时不影响物质传输;5)简单的设计便于将来可能的批量生产和临床应用。该装置表面是纳米纤维膜,核心是海藻酸钠水凝胶(如图1),纳米纤维膜孔径在1微米左右,能有效防止宿主免疫细胞进入装置,同时能防止递送的外源细胞逃逸到宿主体内,保障了安全性;并且纳米纤维膜的多孔结构能保障物质交换(例如氧气、葡萄糖、胰岛素等),利于细胞存活和感知调节血糖变化。海藻酸钠水凝胶的优势是成胶容易,并且能将胰岛分散开,使其不容易聚团而导致缺氧坏死,同时还能将较大的蛋白如抗体隔离在外,有一定免疫保护作用。

图1. 纳米纤维膜免疫隔离装置示意图及装置图
研究者首先在小鼠体内测试该装置的生物相容性。在三个临床移植位点(皮下、腹部大网膜、腹腔)中,她们发现腹腔引起的免疫反应最小 ,同时没有组织粘黏,便于装置的取出。因而在后续的实验中,研究者都将装置移植到小鼠腹腔中进行研究。进而,她们利用荧光素酶在小鼠体内能生物发光来追踪细胞的存活,她们发现装置能保护胰岛和癌细胞系4T1在同种异体环境中存活长达150天,然而没有装置保护的细胞在短短14天内就会被宿主排斥。紧接着研究者利用一系列不同来源的胰岛细胞,包括同种同体小鼠胰岛、同种异体小鼠胰岛、异种异体大鼠胰岛以及人胰岛在小鼠糖尿病模型中都实现了对胰岛细胞的长期保护及血糖稳态的有效控制(长达200天),证明了该装置的安全性和功能性。
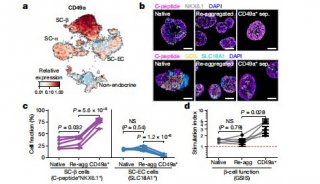
然而最具有临床应用价值的是人干细胞来源的胰岛细胞(stem cell-derived β cells, SC-β cells)。在免疫缺陷的糖尿病小鼠中,用装置递送人干细胞来源的胰岛细胞能逆转小鼠糖尿病,并控制血糖长达120天,这些包裹的胰岛细胞在体内能响应血糖变化并且分泌胰岛素,将装置取出后,组织切片表明胰岛细胞在装置中存活良好,表达β细胞的标志物如胰岛素、C肽和转录因子NKX6.1 (如图2)。进而,研究者在免疫功能健全的糖尿病小鼠模型中,用装置递送人干细胞来源的胰岛细胞也能恢复正常血糖,进一步证明了装置的免疫隔离作用及功能。
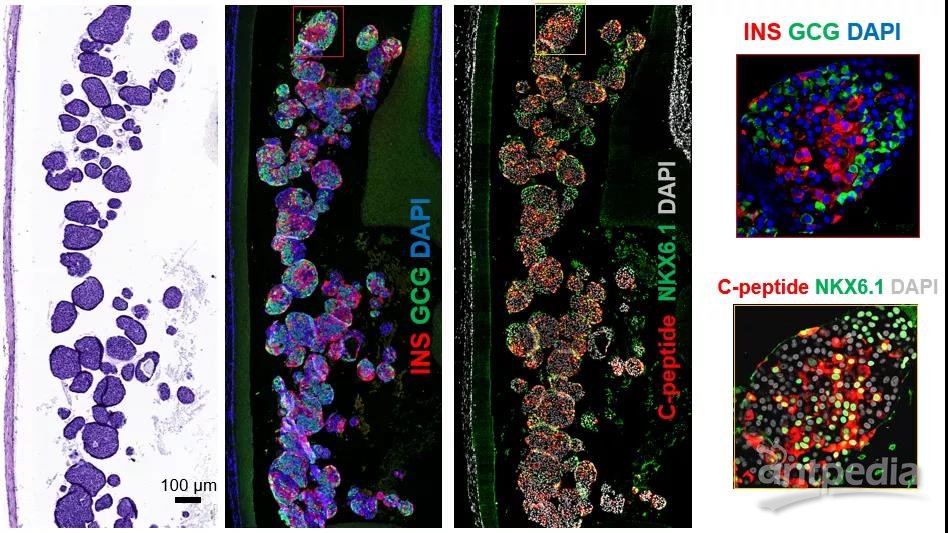
图2. 人干细胞来源的胰岛细胞在装置中存活120天,且表达胰岛细胞特异性标志物。
为了证明该装置临床应用的可行性,该团队扩大了装置的尺寸,利用腹腔镜微创技术,将载有人干细胞来源胰岛细胞的装置递送到实验狗的腹腔中,两周后再次利用腹腔镜能成功地将装置完整地取出,几乎没有组织粘黏。同时能观察到装置中仍有表达胰岛素的胰岛细胞存活,证明了该项技术的临床应用潜力。

图3. 载有人干细胞来源胰岛细胞的装置在大动物模型中的应用。(A)利用腹腔镜将装置移植到大动物体内,(B)利用腹腔镜将装置从大动物体内取回。
康奈尔大学马明林教授及华盛顿大学Jeffrey Millman教授为该论文的共同通讯作者,马明林团队长期研究和开发具有安全性、功能性、生物相容性界面的免疫隔离装置,Jeffrey Millman团队分化并提供人干细胞来源的胰岛细胞,第一作者为康奈尔大学博士生王茜,同时基于该研究申请了两项美国和世界ZL保护。
-
焦点事件

-
项目成果
-
项目成果

-
科技前沿
-
项目成果
-
项目成果
-
科技前沿



















