石枫Angew:基于轴手性苯乙烯的有机小分子催化剂的设计
催化不对称合成的核心是开发高效的手性催化剂,而开发高效手性催化剂的关键是发现优势手性骨架。每一类优势手性骨架的诞生都会推动高效手性催化剂的研发。因此,设计新型的优势手性骨架、开发其衍生的高效手性催化剂,是化学家们孜孜以求的目标。近几十年中,轴手性骨架已被证明是一类开发手性催化剂及配体的优势骨架。其中,轴手性联萘骨架在催化不对称合成领域的应用最为广泛,目前已经有超过300种基于该类轴手性骨架的催化剂和配体实现了商业化,例如BINAP、BINOL、BINOL衍生的手性磷酸和磷酰胺等(图1a)。然而,与之形成鲜明对比的是,轴手性苯乙烯这类新型的手性骨架在不对称催化领域的应用却十分有限,尚未实现该类轴手性骨架衍生的催化剂和配体的商业化(图1b)。文献中也仅有几例零星的报道,例如南方科技大学谭斌课题组开发的ECPA和EBINOL-Phos(Nat. Catal., 2019, 2, 504)、浙江大学史炳锋课题组开发的CCA和S-olefin(Angew. Chem. Int. Ed., 2020, 59, 6576; J. Am. Chem. Soc., 2021, 143, 12335)。
造成上述现象的原因是研发轴手性苯乙烯衍生的手性催化剂和配体存在许多挑战性问题,主要包括(图1c):(1)高对映选择性构建轴手性苯乙烯骨架的策略非常有限;(2)难以在轴手性苯乙烯骨架上引入活化基团或官能团;(3)缺乏对此类新型手性催化剂和配体的深层次理解。因此,非常迫切需要对轴手性苯乙烯衍生的催化剂和配体进行理性设计,并探索它们在不对称催化中的应用。

图1. 轴手性联萘与苯乙烯骨架的对比以及研发轴手性苯乙烯类催化剂存在的挑战性问题
为了解决上述挑战性问题,江苏师范大学石枫课题组理性设计了一类新型的基于轴手性苯乙烯骨架的硫脲-叔胺催化剂。该课题组曾经采用催化动力学拆分的策略(图2a),高对映选择性地获得了一类新型的基于氧化吲哚的轴手性苯乙烯骨架(J. Am. Chem. Soc., 2020, 142, 15686)。基于此工作,作者设想是否可以利用氨基这一活性位点,在轴手性苯乙烯骨架上引入活化基团或官能团,从而实现轴手性苯乙烯衍生的手性催化剂或配体的开发。在该设计中,作者在轴手性苯乙烯骨架上引入了手性硫脲-叔胺基团(图2b),设计思路是:(1)硫脲-叔胺基团可以通过简便的合成路线引入到轴手性苯乙烯骨架中;(2)手性硫脲-叔胺基团不仅可以作为氢键给体和有机碱,具有多重活化位点,而且可以在轴手性苯乙烯骨架上引入多重手性元素,从而为新型手性催化剂提供多重手性调控位点,有利于在不对称催化中控制反应的对映选择性。因此,该类新型的手性催化剂将具有独特的优势,例如简便的合成路线、多重手性元素和多重活化位点,这将有利于解决研发苯乙烯类手性催化剂中存在的挑战性问题。

图2. 轴手性苯乙烯衍生的叔胺-硫脲催化剂的理性设计思路
作者拟将该类新型的手性有机小分子催化剂应用于2-苯并噻唑亚胺的催化不对称环化反应中,这是由于该类反应是对映选择性合成生物活性手性苯并噻唑衍生物的重要方法。但是,2-苯并噻唑亚胺通常作为氮杂二烯,参与催化不对称(4+n)环化反应(图3a)。相反,2-苯并噻唑亚胺却很少作为亚胺参与(2+n)环化反应,这主要是该类反应存在一些挑战性问题,例如控制反应的化学选择性、采用有效的有机小分子催化剂、寻找到合适的反应物等(图3b)。为了解决这些挑战性问题,作者希望采用轴手性苯乙烯衍生的硫脲-叔胺作为高效的有机小分子催化剂,来活化2-苯并噻唑亚胺1与高酞酸酐2,实现它们之间的化学选择性、非对映选择性和对映选择性(2+4)环化反应(图3c)。所以,该工作将不仅首次实现轴手性苯乙烯衍生的硫脲-叔胺催化剂的设计,以及实现第一例2-苯并噻唑亚胺参与的催化不对称(2+4)环化反应,而且将深入理解该类轴手性苯乙烯衍生的有机小分子催化剂。
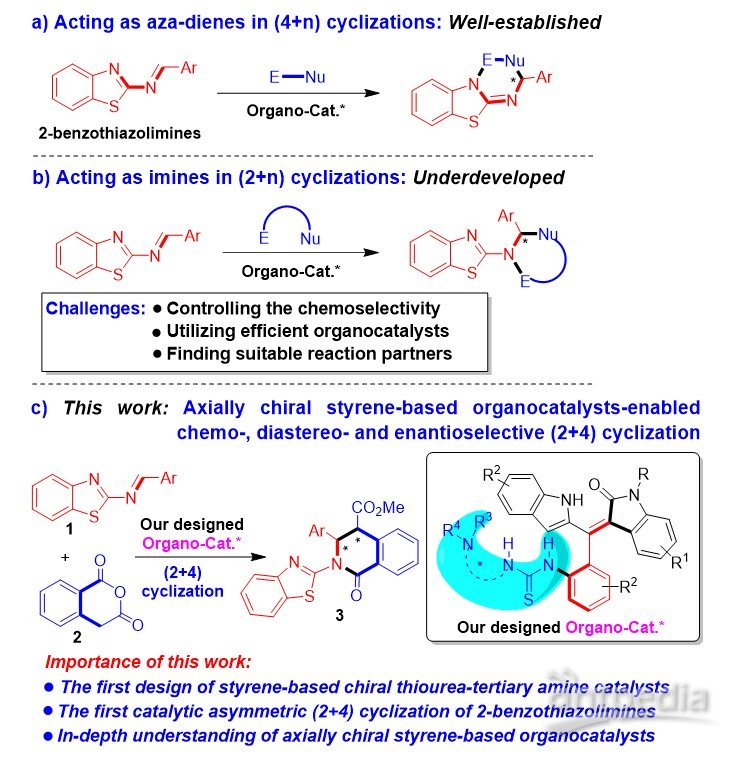
图3. 2-苯并噻唑亚胺参与的催化不对称环化反应概况以及轴手性苯乙烯类催化剂促进的(2+4)环化反应设计
在上述设计思路指引之下,作者首先合成了轴手性苯乙烯衍生的硫脲-叔胺催化剂4-7(图4)。作者采用消旋的氧化吲哚衍生的苯乙烯(rac-I)和廉价易得的手性胺II作为原料,通过两步反应,就以较高的收率得到一系列兼具轴手性和中心手性的有机小分子催化剂4a-7a和4b-7b。因此,该方法为这类新型轴手性苯乙烯衍生的有机小分子催化剂提供了简便高效的合成路线,该类催化剂具有结构可调控、多重手性元素和多个活化位点等优势。

图4. 轴手性苯乙烯衍生的硫脲-叔胺催化剂的合成
在实现该类新型手性催化剂的合成之后,作者尝试了该类催化剂催化下2-苯并噻唑1a与高酞酸酐2a的不对称(2+4)环化反应(表1)。首先,筛选了轴手性苯乙烯衍生的硫脲-叔胺催化剂4-7,发现含有奎宁片段的轴手性苯乙烯催化剂6a的效果最好,催化反应可以达到88% ee(entry 5)。为了与市售催化剂进行初步对比,在相同条件下,作者尝试了一系列奎宁衍生的催化剂8。其中,效果最好的市售催化剂8a催化该反应时,只能达到44% ee(entry 9)。这说明作者设计的新型催化剂在对映选择性控制方面,优于相同类型的市售催化剂,轴手性苯乙烯骨架的确对反应的对映选择性控制起着重要作用。随后,作者又对反应条件进行了仔细地优化,最终以94%的收率、>95:5 dr、92% ee获得目标产物3aa。
在获得最佳反应条件基础之上,作者对底物适用范围进行了研究(图5),发现带有不同取代基的2-苯并噻唑亚胺1和高酞酸酐2都能很好地适用于此反应,可以高收率、高对映选择性地得到一系列(2+4)环化产物3。

图5. 催化不对称(2+4)环化反应的底物适用范围
为了研究反应的适用性和产物的用途(图6),作者进行了放大量实验以及衍生化实验,获得了优良的收率,对映选择性也基本能保持。

图6. 放大量和衍生化实验
为了研究新型催化剂6a中轴手性苯乙烯骨架的作用,作者进行了一系列控制实验,分别尝试10%催化量的催化剂6a、6b以及市售催化剂8对模板反应的催化效果(图7)。由于这些催化剂的不同点是连接奎宁母核的基团不同,所以催化的结果就能体现这些基团对反应的影响。结果表明催化剂6a比其非对映异构体6b的催化效果好(91% ee vs. 81%),并且6a、6b均比市售催化剂8效果好。有趣的是,6a、6b催化反应得到产物3aa的绝对构型相同,这表明轴手性苯乙烯骨架并不决定产物的绝对构型,但是对反应的对映选择性控制具有重要作用。值得注意的是,轴手性苯乙烯衍生的催化剂6a比市售催化剂8在控制反应的对映选择性方面,具有突出的优势(91% ee vs. 48%–76% ee)。所以,这些结果显示,催化剂6a的轴手性苯乙烯骨架对控制(2+4)环化反应的对映选择性起着重要作用,可能是产生了一种手性环境来增强奎宁母核的手性诱导作用。
为了深入理解新型催化剂6a的作用及其对底物的可能活化模式,石枫课题组与汕头大学倪绍飞博士进行合作,对6a催化的不对称(2+4)环化反应进行了理论计算。如图8所示,在形成主要对映异构体(3R,4R)-3aa的关键过渡态TS1中,催化剂6a的硫脲-叔胺基团和轴手性苯乙烯骨架都与两种反应物形成了多重氢键,这说明催化剂6a的多重手性元素发挥协同作用,来控制(2+4)环化的反应性和对映选择性。为了分析对映选择性产生的根源,作者也计算了形成次要对映异构体(3S,4S)-3aa的关键过渡态TS1',与TS1进行对比。在TS1中,催化剂6a的结构类似于一个手性口袋,主要包括三个部分:叔胺基团(位点A)、硫脲基团(位点B)、轴手性氧化吲哚衍生的苯乙烯(位点C)。催化剂6a的手性口袋产生了一种手性环境,这三个部分(位点ABC)协同作用,与底物1a和2a形成了多重氢键(b1至b8)。值得注意的是,氧化吲哚衍生的轴手性苯乙烯(位点C)与底物形成了三个氢键,即氧化吲哚的羰基不仅与底物1a的前手性中心的CH形成一个弱的氢键(b4 = 2.954 Å),而且与底物2a形成了两个氢键(b7 = 2.481 Å, b8 = 2.340 Å),由此在手性口袋中控制住了两种底物反应时的空间取向。相反,在TS1'中,只有叔胺基团(位点A)和硫脲基团(位点B)与底物形成几个氢键,而氧化吲哚衍生的轴手性苯乙烯骨架(位点C)与底物之间没有氢键作用,导致了TS1'的能垒(20.6 kcal/mol)比TS1的能垒(17.3 kcal/mol)高。所以,这两个过渡态的能垒差是3.3 kcal/mol,与实验得到3aa的高对映选择性相吻合。更重要的是,通过分析对映选择性产生的根源,揭示出氧化吲哚衍生的轴手性苯乙烯骨架与底物之间形成氢键对控制对映选择性起着重要作用。
为了解释轴手性苯乙烯衍生的催化剂6a比市售催化剂8a催化效果好的原因,作者对比了这两种催化剂作用下(2+4)环化反应的关键过渡态TS1和TS3(图9)。TS3是催化剂8a作用下形成主要对映异构体(3R,4R)-3aa的关键过渡态,在TS3中,催化剂8a的手性叔胺和硫脲基团与底物1a和2a产生了氢键作用,该过渡态的能垒是21.1 kcal/mol。而形成次要对映异构体(3S,4S)-3aa的关键过渡态TS3' 的能垒是22.7 kcal/mol,所以TS3'与TS3的能垒差是1.6 kcal/mol。通过对比TS3与TS1可以发现,新型催化剂6a催化下的关键过渡态TS1具有明显的优势,主要包括:形成更多的氢键、具有类似手性口袋的手性环境、过渡态能垒较低(17.3 kcal/mol)、形成两种对映异构体的能垒差较大(3.3 kcal/mol)。值得注意的是,理论计算还发现,催化剂6a的结构中,吲哚的NH基团与氧化吲哚的C=O基团形成了一个分子内氢键(1.800 Å)。所以,催化剂6a的吲哚基团虽然没有直接与底物发生相互作用,但是这个分子内氢键使吲哚环与氧化吲哚环紧密地连接在一起,由此形成一个坚实的手性口袋。TS1的能垒比TS3低,这一计算结果与实验观察到的6a催化下3aa的收率(85%)要比8a催化下的收率(55%)更高相一致。此外,TS1'与TS1的能垒差比TS3'与TS3的能垒差更高,这一计算结果很好地解释了6a催化下3aa的对映选择性(91% ee)比8a催化下的对映选择性(76% ee)更高的原因。
因此,理论计算不仅为轴手性苯乙烯衍生的催化剂6a在控制反应性和对映选择性方面具有明显优势提供了可能的原因,而且阐明了该类手性有机小分子催化剂的重要特点,例如具有多重活化基团、多重手性元素、可以形成结构上刚柔相济的手性口袋,从而有助于深入理解该类新型的手性催化剂。
综上所述,石枫课题组巧妙地在氧化吲哚衍生的轴手性苯乙烯骨架中引入手性硫脲-叔胺基团,设计了一类基于轴手性苯乙烯的新型有机小分子催化剂。该类催化剂具有独特的优势,例如简便高效的合成路线、具有多重手性元素和多重活化基团,为解决研发轴手性苯乙烯类催化剂中存在的挑战性问题提供了有效的策略。该类新型的手性有机小分子催化剂被成功地应用于2-苯并噻唑亚胺与高酞酸酐的不对称(2+4)环化反应,实现了对反应的化学选择性、非对映选择性和对映选择性的控制,从而解决了2-苯并噻唑亚胺参与的催化不对称(2+n)环化反应中存在的挑战性问题。更为重要的是,理论计算揭示,氧化吲哚衍生的轴手性苯乙烯骨架与底物之间的氢键作用,对控制反应性和对映选择性具有重要作用。此外,该类催化剂具有多重活化基团和多重手性元素等特点,使其能够形成结构上刚柔相济的手性口袋,有利于催化剂与底物之间形成多重氢键作用。这些研究将有助于深入理解该类新型的有机小分子催化剂,同时也有望对轴手性苯乙烯类催化剂的设计与应用产生指导意义。
上述研究成果发表在Angew. Chem. Int. Ed.,江苏师范大学硕士研究生刘思嘉为第一作者,实验部分由石枫教授和张宇辰副教授共同指导完成,理论计算及相关内容由倪绍飞博士和石枫教授共同探讨完成,本科生陈嘉仪参与了计算部分,同时感谢浙江大学洪鑫教授在采用CREST软件进行构象搜索中提供的帮助。该项工作主要得到了国家自然科学基金和江苏省自然科学基金的资助。