细胞与组织亚细胞分辨的透射式MALDI-2质谱成像

再帕尔•阿不力孜科研团队 第61期
中国医学科学院药物研究所
天然药物活性物质与功能国家重点实验室
文献整理:金波 指导教师:贺玖明
德国明斯特大学K. Dreisewerd团队在《Nature Methods》上发表了一篇题为“Transmission-mode MALDI-2 mass spectrometry imaging of cells and tissues at subcellular resolution”的研究论文,将透射模式几何的基质辅助激光解吸电离质谱成像(t-MALDI-MSI)技术和激光诱导后电离(MALDI-2)技术结合,开发了t-MALDI-2离子源,并在亚细胞分辨水平实现了组织和细胞中脂质的质谱成像分析。
背景介绍
t-MALDI-MSI的空间分辨率可达到1μm或更小,这种无标记方法可以表征(亚)细胞水平上的组织和细胞中化合物的空间分布。但是,该技术的主要局限是小像素尺寸下离子丰度会降低。MALDI-2是一种能提高脂质和代谢物离子丰度并扩大化学覆盖范围的有效方法。将两种技术结合,应用于组织和细胞的脂质检测,可以实现高空间分辨和高通量的质谱成像分析。
实验设计
t-MALDI-2-MSI的离子源设计如图1所示。在t-MALDI部分,激光1(laser 1)经过反射,从样品背面聚焦于样品,样品固定在透明基板上。这种背面传输(即透射模式)的几何学相比于传统的反射角度传输可以实现较大的激光聚焦角,因此可以在近紫外激光波长处获得亚微米直径的激光光斑,提高空间分辨率。此外,这个角度方便显微镜和相机的部署,从而可以对样品进行在线的显微观察(如图1下方所示)。MALDI-2部分的实现是引入另一路激光2(laser 2),对由laser 1激发的样品(分析物-基质)蒸汽进行类似MALDI的二次电离反应。激光2与激光1有固定的激光脉冲延迟,且激光2与样品保持一定距离△Z(500μm)。二次电离反应需要几毫巴(~10mbar)冷却的缓冲气体(氮气)环境,以减慢样品蒸汽的移动速度,使基质分子发生共振双光子电离,并进行充分的离子-分子反应。质谱仪为Q Exactive。将所建立的t-MALDI-2-MSI方法用于小鼠脑和肾组织以及细胞培养物的分析。
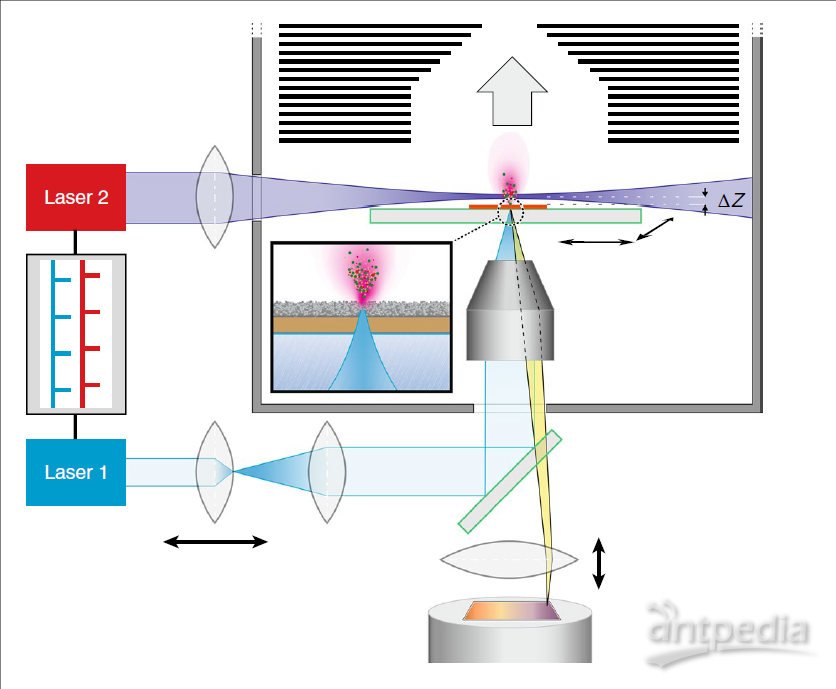
图1 t-MALDI-2-MSI的示意图。主动调Q开关Nd:YLF激光(激光1,λ= 349 nm,M2〜1.05)通过透射紫外线的×50倍物镜以背面照射几何角度聚焦到基质包覆的样品上。焦点直径的微调是通过预先聚焦的望远镜单元实现的。开放式压电驱动的平移台可在纳米范围内高精度移动样品。Nd:YAG激光(激光2,λ=266 nm)与样品有一定的距离△Z,并以一定的脉冲延迟与分析物-基质蒸汽相交。通过相同的光束路径以及使用分光器和电荷耦合器件(CCD)相机对样品进行显微镜观察
实验结果
1 组织切片
与t-MALDI相比,使用t-MALDI-2在提高离子丰度和化合物覆盖范围上均有明显改进。显微镜明场图像(图2a,f)中,小鼠小脑的主要区域(例如,白质、颗粒层和分子层)均容易区分。此外,Purkinje 细胞(图2f)亦清晰可见。
m/z = 605.552(图2b,g)为质子化的二酰基甘油片段[DAG(36:1) -H2O + H] +(以下简称[DAG(36:1)] +)。这些离子为总脂肪酰基组成为36:1的不同甘油磷脂在丢失极性头部基团后发生源内裂解而成。值得注意的是,Purkinje细胞在基于DAG的离子图像中显示为亮点,表明36:1甘油磷脂在这些神经元中的过度表达。
m/z = 775.527(图2d)为[PC(40:6) -N(CH3)3 + H] +,从PC头部丢失N(CH3)3基团是MALDI中另一个重要的源内裂解途径。多不饱和PC(40:6)在Purkinje细胞系统中富集,显示Purkinje细胞的复杂树突系统具有大约100 nm~1μm的宽度并延伸到ML中。
m/z = 792.554(图2c,h)为[PE(40:6)+ H]+, 这种多不饱和脂质在颗粒层中显示出最高的信号强度,其离子图像很好地显示了独特的颗粒结构。有趣的是,在Purkinje细胞中发现了几乎等浓度的这种脂质。但是,由于可能存在组织依赖型的离子抑制效应,从定量角度解释MS信号需格外注意。
m/z = 810.681(图2e)为己糖神经酰胺[HexCer(42:2)+ H]+,推测主要是半乳糖酰基鞘氨醇GalCer(d18:1 / C24:1)。它主要分布于白质,其丰度在过渡到颗粒层后迅速降低,在分子层中仅发现一些残留表达。其他含不同脂肪酰基部分的HexCer脂质也呈现相似的分布。
在负离子模式下,所有的磷脂和糖脂主要被检测为[M-H]-种类。通常认为HCCA基质在负离子模式下对脂质测量并无助益,但使用t-MALDI-2产生的负离子丰度与正离子模式实验的丰度基本相似(图 2j–m)。两种离子模式都产生了非常低的基质背景信号,这极大地简化了数据解释。
m/z = 699.497(图2j)为磷脂酸[PA(36:2) -H]-。鉴于真实的PA(36:2)在小鼠大脑的表达水平很低,因此推测观察到的信号至少部分是由其他36:2甘油磷脂的头部丢失基团引起的。
m/z = 790.540(图2k)为[PE(40:6) -H]-,其离子图像与图2c所示的正离子模式中确定的图像完全一致。说明t-MALDI-2-MSI方法不仅具有良好的耐用性,并且降低了对离子抑制作用的敏感性。
m/z = 786.529(图2l)和m/z = 888.624(图2m)分别为磷脂酰丝氨酸[PS(36:2) -H]-和硫脂[ST(d18:1 / C24:1) -H]-。这里假设d18:1是双尾神经酰胺的主要组成部分。硫脂是髓磷脂的主要成分,尽管可以观察到该离子很少量“扩散”到了周围的颗粒层中,类似于之前讨论的GalCer的方式,但硫脂几乎只在白质中分布。相比之下,PS(36:2)在白质和分子层中具有不同的含量,可能表明与脑中血浆膜结合的磷脂酰丝氨酸具有许多调节功能。值得注意的是,使用t-MALDI-2,还可以在正离子模式下以完全一致的分布有效记录磷脂酰丝氨酸信号。
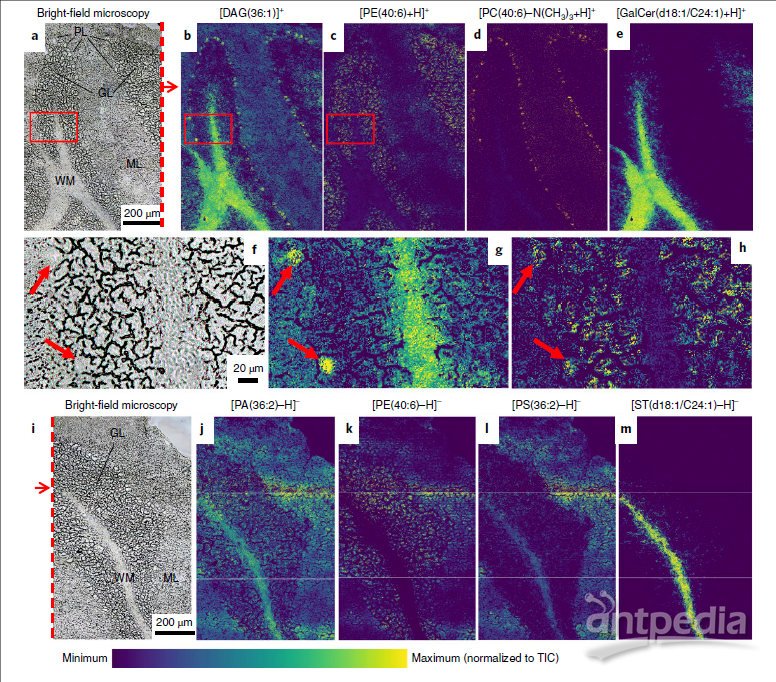
图2 小鼠小脑的t-MALDI-2-MSI图像。a,f,i,在应用基质之前拍摄的小鼠小脑区域的明场显微图像。WM,白质;GL,颗粒层;ML,分子层;PL,Purkinje 层。b–e,g,h,以正离子模式记录的选定磷脂和糖脂的离子图像。b,g:m/z = 605.552,DAG(36:1)+,[M + H] +;c,h:m/z = 792.554,PE(40:6),[M + H] +; d:m/z = 775.528,PC(40:6-N(CH3)3),[M + H] +;e:m/z = 810.682,HexCer(42:2),[M + H] +。f,g和h中的图像分别是a,b和c中轮廓区域的放大图。红色箭头表示Purkinje细胞的细胞体。j–m,以负离子模式记录的选定脂质的离子图像。MSI数据是在三个单独的实验运行中采集的,用白线分隔,然后将数据合并。j:m/z = 699.497,PA(36:2),[M-H]-。k:m/z = 790.539,PE(40:6),[M-H]-。l:m/z = 786.529,PS(36:2),[M-H]-。m:m/z = 888.624,ST(d18:1 / C24:1),[M-H]-。样品台的间距尺寸(根据像素尺寸)设定为1.0μm。将所有信号强度均归一化为总离子数(TIC)。HCCA被用作MALDI基质。对来自四个不同小鼠大脑切片的不同大小的研究区域进行重复实验。所有单独的实验均产生相似的结果。
通过t-MALDI-2-MSI分析,小鼠肾组织的复杂形态和化学成分也得到了很好的再现。
2 单像素的灵敏度
白质区单个1.0μm宽的像素获得的MALDI-2质谱图如图3a所示。共有30磷脂或糖脂得到了结构注释。Orbitrap质量分析器具有高分辨率,如图3b所示,在0.3Da宽的窗口中检测到了m/z 810.541、m/z 810.598和m/z 810.682三个离子,分别为PE(38:2),PC(36:1)和HexCer(42:1)。图3c是这三种脂质在所选小脑区域中差异表达的叠加图,图3d显示了从相邻切片获得的H&E染色图。比较表明,PE(38:2)的[M + K] +加合物主要分布于白质中30-40μm宽的岛中,而PC(36:1)的 [M + Na] +加合物在整个采样区域均有信号,在Purkinje层内和Purkinje层周围,以及白质的岛外略有升高。GalCer(d18:1/24:1)的[M + H] +信号主要在白质中检测到。此外,t-MALDI-2方法的高灵敏度允许获得高分辨的MS/MS数据。
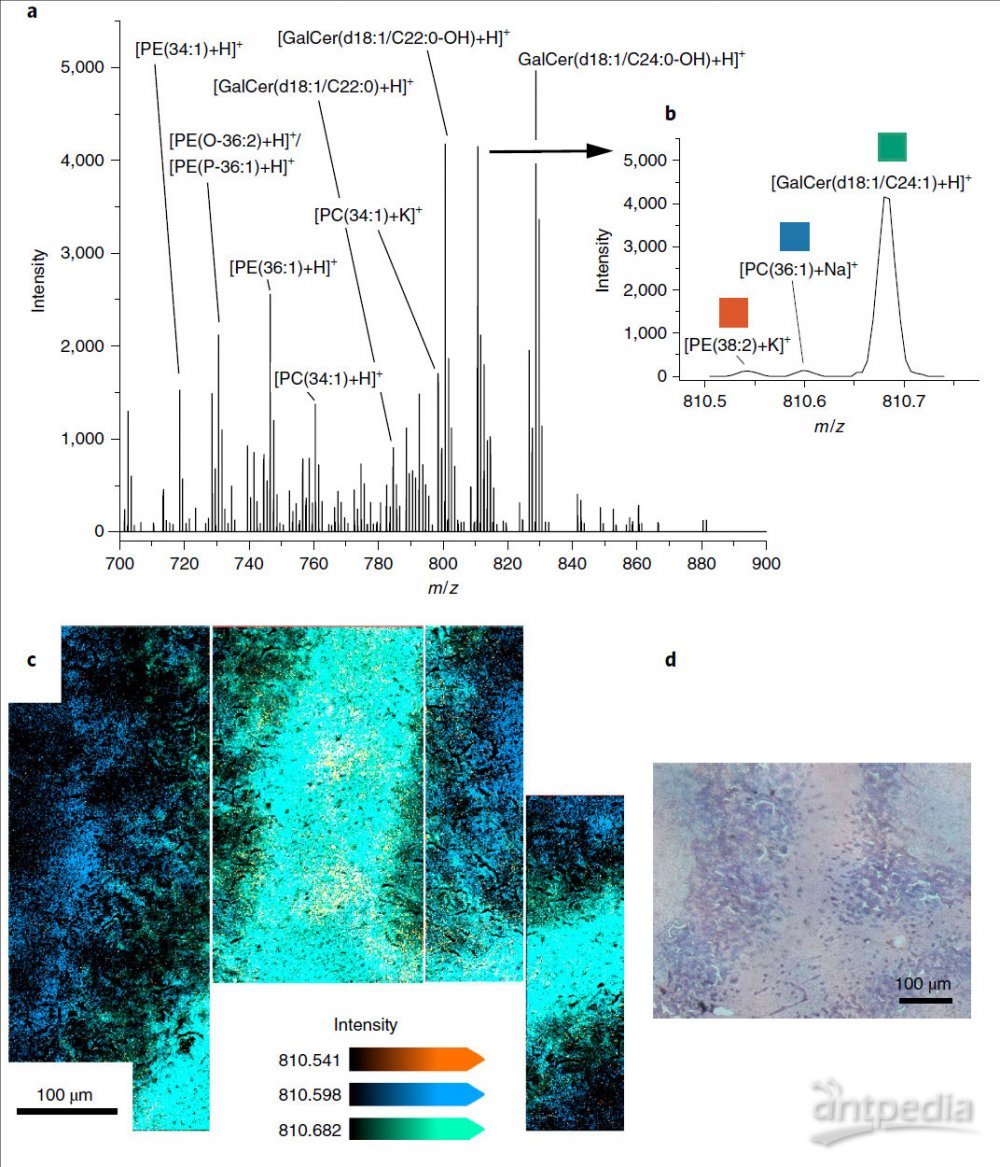
图3 单像素分析。a,从小鼠小脑白质中单个1.0-μm宽的像素获得的代表性t-MALDI-2质谱图。根据它们的质荷比注释了一些主要的磷脂和糖脂。b,m/z区域在810.5和810.8之间的放大图。c,叠加图,显示了在此0.3Da宽的质量窗口中检测到的以下三种化合物的分布:橙色,m/z 810.541,PE(38:2),[M + K] +;蓝色,m/z 810.598,PC(36:1),[M + Na] +;绿色:m / z 810.682,HexCer(42:2),[M + H] +。在四个单独的实验运行中记录了MS图像,这些实验用白线分隔。d,平行组织切片的H&E染色图。以可比较的方式对四个不同的小鼠脑部进行的实验得出了相似的结果。
3 横向分辨率
对单个小鼠小脑切片的平行区域进行了成像(图4),考察不同的像素大小(600nm至10μm)的影响,其他实验参数保持不变。使用以下离子信号区分小脑中白质、灰质和分子层的区域:[DAG(34:1)] +,[M + H] +,m/z = 577.519; PE(36:1),[M + K] +,m/z = 784.525和GalCer(d18:1 / C24:0-OH),[M + H] +,m/z = 828.692。
比较MSI图像,发现横向分辨率随像素尺寸的减小而增加。在颗粒层中发现的微裂缝和裂纹尤为明显,它们的特征尺寸在2-10μm范围内。在像素大小为10μm的情况下,这些精细结构被完全掩盖了,而在像素大小为2.0μm和1.5μm的情况下,这些特征中的最大特征变得明显了。在1.0μm时,颗粒层中的精细结构几乎可被完全分辨,并且在分子层区域2–4μm的小规模裂纹也可被分辨。来自800和600 nm像素大小的数据显示,某些离子种类的检测与细裂纹的存在密切相关(例如,PE(36:1),[M + K] +)。
t-MALDI实验中使用的聚焦激光直径平均约为1.1 -1.2μm。因此,对于1.0μm宽像素的测量是由过采样来进行的,而像素尺寸更小的测量则具有更大的过采样度。由于每个像素都被25次激光照射而被剧烈烧蚀,因此过采样可以最大化横向分辨率。
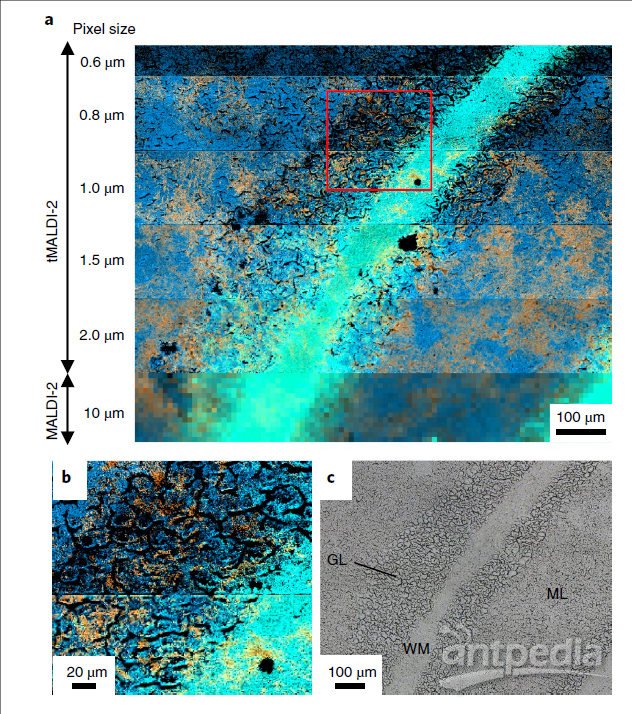
图4 t-MALDI-2–MSI的横向分辨率。a,描绘了小鼠小脑中以下三种选定的脂质离子的分布叠加:蓝色,m/z = 577.519,[DAG(34:1)] +;橙色,m/z = 784.525,PE(36:1,[M + K] +];绿色,m/z = 828.692,HexCer(42:1-OH),[M + H] +。在压电样品台的五个不同步长(定义为像素大小;范围从600 nm到2.0μm)下,使用t-MALDI-2记录了前五个图像,激光束的有效焦距约为1.2μm。底部图像代表传统的MALDI-2-MSI数据,以顶照几何图形记录,像素大小为10.0μm,有效焦距(可见材料烧蚀区域)约为9.0μm。对于600 nm的步长,扫描区域为990×68μm2,对于所有其他设置,扫描区域为990×150μm2。b,在a中用红色框表示的区域的放大图。c,在a中成像的研究区域的明视野显微图像;喷涂HCCA用作MALDI基质。在另一个单独的小鼠大脑样本上进行的可比实验产生了相似的结果。
4 细胞培养物
为了探索t-MALDI方法在单细胞和细胞培养物的化学分析中的潜力,以Vero B4细胞作为研究对象。图5a显示了MS实验之前被基质涂布的细胞培养物的明场显微图像。
图5b显示了m/z = 633.04离子,它可能是由显微镜载玻片的聚-d-赖氨酸涂层产生的。在被细胞体覆盖的位置,该信号原本均匀的强度降低了,在(更密集的)细胞核所在的位置几乎不存在。这种对比允许对细胞培养物进行形态学上的可视化。
与脑组织切片不同,在细胞培养物中许多磷脂和糖脂以[M + In] +离子形式被检测,[PC(34:1)+ In] +的示例如图5d所示。通过MS/MS证实了加合物的形成。这可能因为紧密聚焦的激光束烧蚀了15-30nm厚的铟锡氧化物(ITO)涂层的玻璃基板表面的一小部分。此外,加合物形成的程度取决于有机体的局部密度。例如,被密集细胞核覆盖的区域几乎没有任何[M + In] +信号。如图5e中PC(34:1)所示,如果将特定脂质的所有加合物信号重合,则可在研究的细胞表面获得更均匀的分布。
图5g是以下三个离子图像的叠加图:m/z = 633.04(图5b)、PE(40:6),[M + H] +(图5c)和PC(34:1),[M + K] +(图5e)。显微明场图像和t-MALDI-2图像的比较表明t-MALDI-2可获得亚细胞级的分辨率。PC的[M + K] +加合物主要来自细胞核区域,而质子化的PE(40:6)在其他细胞体的丰度最高。暂时将这一发现归因于整个细胞中钾浓度的不同。此外,更高的细胞核密度可能会导致烧蚀机理的改变。
负离子模式获得了和正离子模式测量中相似的高质量图像。

图5 t-MALDI-2-MSI用于单细胞分析的潜力。a,通过升华施加薄DHB基质层后,在聚d-赖氨酸涂层的ITO载玻片上生长的Vero B细胞的明场显微图像。b,来自基质的特征性背景离子(m/z = 633.042)的图像。c–e,代表性t-MALDI-2–MS离子图像,像素大小为1.0μm。c,PE(40:6),[M + H] +,m/z = 792.554;d,PC(34:1)-N(CH3)3,[M + In] +,m/z = 815.408;e,PC(34:1)的[M + H]+,[M + K] +和[M-N(CH3)+ In] +信号之和,m/z值分别为760.585、798.541和815.408。f,在a的明场显微镜图像中红色轮廓区域的放大图。g,三个物质的重合图像,分别来自背景离子(b;蓝色);PE(40:6),[M + H] +(c,绿色);PC(34:1),[M + K] +,(d;橙色)。h,用内置显微镜单元记录的基质涂覆的细胞培养物的显微明场图像,区域为f中的轮廓区域。两组独立培养和制备的细胞结果相似。(译者注:5c图的标识可能错误,应该为[PE(40:6)+H]+)
5 内置光学显微镜和t-MALDI-MS的配合使用
t-MALDI-2离子源的光学设置允许实现内置显微镜。图5h展示了该显微镜以微米分辨率获得的“在线”图像,在约50×50μm2的视场中显示了五个Vero B4细胞的聚集体。
讨论与结论
本研究为t-MALDI-2-MSI开发了一种新的离子源,它能够以亚细胞水平的分辨率分析组织和细胞培养物。最小的600 nm像素尺寸反映了空间分辨率的显著提高。与之前的高分辨率大气压(AP)和t-MALDI研究相比,激光后电离步骤可将多种类别的磷脂和糖脂的分析灵敏度提高多达几个数量级。对于主要的脂质,可以从约1微米宽的单个像素进行MS/MS分析,从而获得丰富的结构信息。将来也可以将该技术应用于多种次级代谢产物(小分子化合物)的研究。
为了进一步提高该方法的空间分辨率和应用范围,无伪影的样品制备以及超细基质涂层方案至关重要。结合目前被Orbitrap采集软件抑制的低强度离子瞬变的评估,将来有可能实现像素尺寸小于500 nm的t-MALDI-2-MSI分析。内置显微镜单元构成了这个离子源的另一个重要特征。在进一步提高分辨率之后,该在线模块可以记录来自组织切片的自发荧光图像,以便在亚微米分辨率下对光学和离子图像进行共配准。一个令人兴奋的前景是,对荧光标记的细胞或组织区域进行鉴定,再进行靶向的t-MALDI-2分析。这样,就能将两种强大的成像方式融合在一台仪器中。
缩略语
t-MALDI-MSI:Transmission-mode geometry matrix assisted laser desorption ionization mass spectrometry imaging,透射模式几何的基质辅助激光解吸电离质谱成像;MALDI-2:laser-induced post-ionization,激光诱导后电离;DAG:diacylglycerol,二脂酰甘油;PC:phosphatidylcholine,磷脂酰胆碱;PE:phosphatidylethanolamine,磷脂乙醇胺;HexCer:hexosylceramide,己糖神经酰胺;GalCer:galactosylceramide,半乳糖酰基鞘氨醇;PA:phosphatidic acid,磷脂酸;PS:phosphatidylserine,磷脂酰丝氨酸;ST:sulfatide,硫脂;WM:white matter,白质;GL:granular layer,颗粒层;ML,molecular layer分子层;PL, Purkinje layer,浦肯野细胞层;ITO:indium tin oxide,铟锡氧化物
原文文献
M. Niehaus, et al (2019). "Transmission-mode MALDI-2 mass spectrometry imaging of cells and tissues at subcellular resolution." Nature Methods, 16, 925–931
原文链接 https://doi.org/10.1038/s41592-019-0536-2