李国红/朱明昭组揭示H2A.Z对DNA复制起始位点调控
已知大部分生物的遗传信息都储存在双链DNA上,遗传信息的精确传递对生命的繁衍和进化至关重要。而这个信息传递过程依赖于DNA复制这一基本的细胞活动。DNA复制包含起始、延伸和终止三个步骤。细胞在G1期时,复制起始识别复合物(Origin Recognition Complex, ORC)识别染色质上的复制位点,进一步的招募DNA解旋酶MCM等,形成复制前体复合物(pre-Replication Complex),完成复制起始位点的认证。而当细胞进入复制期S期时,被认证的复制起始位点被选择性的激活使用【1,2】。
在真核生物中,DNA与组蛋白八聚体相互缠绕,形成核小体。而核小体再经过进一步的折叠,形成更高级结构的染色质。而在复杂的染色质上也存在多个复制位点。真核生物DNA复制起始位点的选择受DNA序列和表观遗传因素共同调控【3】。在酿酒酵母中,已经发现能被复制起始识别复合物(ORC)识别的具有保守序列的DNA复制起始位点【4】。然而,在其他多细胞真核生物中,还没有鉴定出能被ORC识别的特定保守序列。目前关于ORC是如何在染色质上选择DNA复制起始位点的机制仍然不清楚。
2019年12月25日,来自中国科学院生物物理研究所的李国红课题组与朱明昭课题组合作,在Nature上发表了题为“H2A.Z facilitates licensing and activation of early replication origins”的文章。该文章发现组蛋白变体H2A.Z能够通过H2A.Z-SUV420H1-H4K20me2-ORC1通路帮助在染色质上进行复制起始位点的选择,并进一步发现受H2A.Z调控的复制位点相比与其他的复制位点有着更高的复制信号,也更偏向在复制期早期被激活使用。

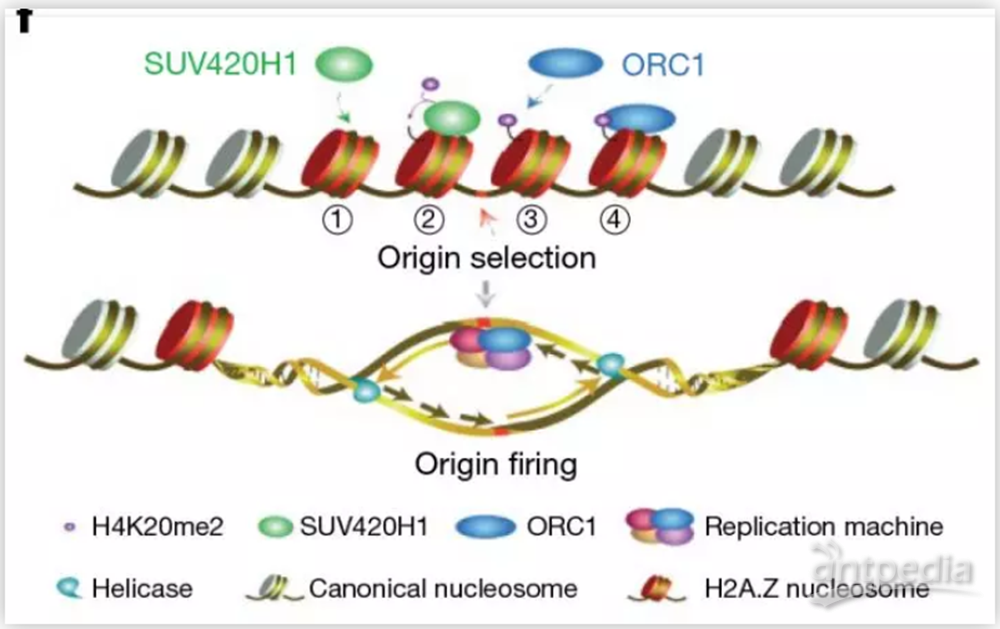
作者首先发现在HeLa细胞中敲低组蛋白变体H2A.Z会影响细胞的增殖。为了分析H2A.Z调控增殖的原因,作者通过质谱实验在HeLa细胞内鉴定了与H2A.Z核小体相互作用的蛋白。质谱结果发现,许多复制前体复合物中的亚基都特异的富集在了H2A.Z核小体上。接下来作者通过生物化学和细胞生物学等实验,详细了分析H2A.Z核小体与复制前体复合物相互作用的机制。研究结果发现含有组蛋白变体H2A.Z的核小体能够通过直接结合甲基化酶SUV420H1,促进核小体上的H4组蛋白第20位赖氨酸发生二甲基化修饰(H4K20me2)。而带有H4K20me2修饰的H2A.Z核小体,能够招募复制前体复合物中的ORC1(Origin Recognition protein 1)蛋白,从而帮助染色质上复制起始位点的选择。
通过全基因组学分析,作者发现在HeLa细胞中,H2A.Z与H4K20me2、ORC1以及被激活使用的复制起始位点在全基因组上有非常高比例的共定位。而当在HeLa细胞中敲低H2A.Z时,H4K20me2、ORC1以及复制信号都有大幅降低。作者进一步分析受H2A.Z调控的复制起始位点的特征,发现这类复制位点比其他的复制位点有更高的复制信号,并偏向在复制期早期被激活使用。
为了研究这个通路在生理条件下的作用,作者构建了在小鼠T细胞中条件性敲除H2A.Z的小鼠。研究结果发现,在T细胞中条件性敲除H2A.Z会导致活化后的T细胞增殖变慢,复制信号显著降低。
综上所述,该研究阐述了一个新颖的由H2A.Z介导的DNA复制表观遗传调控机制(H2A.Z-SUV420H1-H4K20me2-ORC1),对理解真核生物DNA复制起始位点的选择提供了新的视角,同时也为未来探讨DNA复制起始的异常调控在肿瘤发生过程中的作用机制提供了新思路。
据悉,中国科学院生物物理研究所生物大分子国家重点实验室李国红课题组的龙海珍,张力圩,温增麒,以及生物物理所感染与免疫重点实验室朱明昭课题组的的吕梦婕为本文的共同第一作者。朱明昭课题组的金彩薇,生物物理研究所质谱平台杨福全课题组的陈秀兰,清华大学邓海腾课题组的张文浩,北京大学裴剑锋课题组的李佟清对本文也有重要贡献。
参考文献
1. O’Donnell, M., Langston, L. & Stillman, B.Principles and concepts of DNA replication in bacteria, archaea, and eukarya. Cold Spring Harb. Perspect. Biol. 5, a010108 (2013).
2. Fragkos,M., Ganier, O., Coulombe, P. & Méchali, M. DNA replication origin activationin space and time. Nat. Rev. Mol. CellBiol. 16, 360–374 (2015).
3. MacAlpine,D. M. & Almouzni, G. Chromatin and DNA replication. Cold Spring Harb. Perspect. Biol. 5, a010207 (2013).
4. Dhar,M. K., Sehgal, S. & Kaul, S. Structure, replication efficiency andfragility of yeast ARS elements. Res.Microbiol. 163, 243–253 (2012)
-
项目成果
-
科技前沿

-
科技前沿

-
科技前沿
-
焦点事件