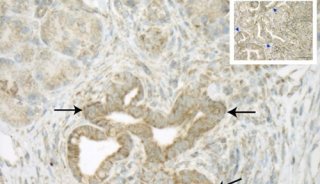
中科院Cell Res发表线粒体自噬综述文章
来自中科院动物研究所和日本大阪大学的研究人员,在6月6日的《细胞研究》(Cell Research)杂志上发表了题为“Receptor-mediated mitophagy in yeast and mammalian systems”的一篇综述文章。
中科院动物研究所的陈佺(Quan Chen)研究员和大阪大学的Kaori Sakakibara是这篇文章的共同通讯作者。陈佺研究员的主要研究方向是线粒体生物学和细胞凋亡机制的研究,同时进行抗癌药物筛选和化学生物学及癌症干细胞等方面的研究。近年来,研究组在国际主流杂志 Nature Cell Biology, Nature Communications等杂志发表论文60多篇。
健康线粒体通过三羧酸(TCA)循环和氧化磷酸化作用,成为细胞的能量转换主要场所。线粒体决定了细胞的生死。在凋亡因子的刺激下线粒体外膜透化释放出细胞色素C, 细胞色素C可与它的细胞质受体Apaf1结合形成凋亡体,激活caspase级联反应诱导凋亡。线粒体还是氧化磷酸化过程中过氧化物生成的主要位点。此外,线粒体也是铁代谢和脂质氧化的中心。
鉴于线粒体在细胞生命活动中的这些重要作用,受损伤的或不需要的线粒体必须被有效清除,以保证细胞正常生命活动的进行。线粒体自噬(Mitophagy)就是这样一种通过自噬机制选择性清除受损伤或不必需的线粒体的过程。线粒体自噬还可能参与了红细胞(哺育动物红细胞没有细胞核和线粒体)的发生和成熟过程。线粒体自噬的异常可能与神经退行性疾病,糖尿病和肿瘤的发生有密切关系。线粒体自噬的分子调控机制目前是线粒体和细胞自噬研究领域同行广泛关注的焦点问题。
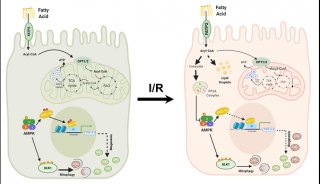
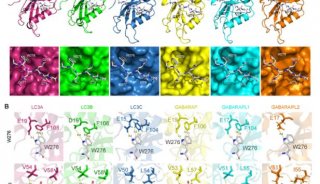
几种蛋白质受体,包括酵母Atg32以及哺乳动物系统NIX/BNIP3L、BNIP3和FUNDC1都在线粒体自噬中直接发挥作用。Atg32与Atg8及Atg11在线粒体表面发生相互作用,促进了核心Atg组装以实现线粒体自噬。NIX/BNIP3L、BNIP3和FUNDC1则通过LC3互作区域(LIR)直接结合LC3(哺乳动物中Atg8同系物)来激活线粒体自噬。
近期的一些研究证实,受体介导的线粒体自噬受到可逆的蛋白质磷酸化作用调控。在酵母中Casein kinase 2 (CK2)磷酸化Atg32,激活线粒体自噬。与之相反,在哺乳动物中Src激酶和CK2磷酸化FUNDC1阻止了线粒体自噬。而响应缺氧和FCCP处理,线粒体磷酸酶PGAM5可使得FUNDC1去磷酸化激活线粒体自噬。
在这篇综述文章中,作者们概述了有关受体介导的线粒体自噬激活潜在分子机制的最新研究进展,并探讨了这一分解代谢过程对健康和疾病状态的影响。
-
科技前沿
-
项目成果

-
项目成果
-
科技前沿