973首席科学家孙颖浩Cell子刊发表新成果
SPOP基因编码E3泛素连接酶的接头蛋白,在多种类型的癌症中频繁突变。不过,人们并不清楚SPOP作为肿瘤抑制子是怎样起作用的。
第二军医大学和Wistar研究所的科学家们经过深入研究,揭示了SPOP抑制癌症的作用机制。这项研究发表在十月二十九日的Cell Reports杂志上,文章的通讯作者是第二军医大学的孙颖浩教授和Wistar研究所的Rugang Zhang。(延伸阅读:孙颖浩、徐剑锋领衔发表重要癌症成果)
研究人员发现,SPOP能够靶标SENP7(deSUMOylase)使其降解,并由此促进细胞衰老。而细胞衰老是一种重要的肿瘤抑制机制。
研究显示,癌症相关的突变SPOP不能诱导细胞衰老和SENP7降解。而SPOP诱导的衰老与HP1α介导的表观遗传学基因沉默。进一步研究表明,SENP7降解增加了HP1α的SUMO化修饰,增强了相应的表观遗传学基因沉默。
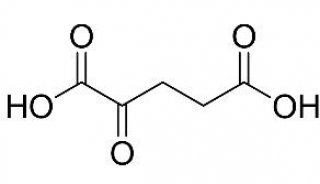
SUMO(小泛素相关修饰物)是泛素类蛋白家族的重要成员,在真核生物中广泛存在而且高度保守。SUMO与蛋白的共价连接称为SUMO化,是一种重要的蛋白质翻译后修饰,这种修饰对于蛋白质的功能、活性和定位是非常重要的。
SUMO与泛素在二级结构上极为相似,不过SUMO与泛素的功能并不相同,泛素化主要介导蛋白酶降解,SUMO化则发挥着更为广泛的功能。许多调控基因转录的重要蛋白都存在SUMO化修饰,在大多数情况下SUMO化与转录活性的抑制有关。
研究人员指出,在携带SPOP突变的前列腺癌样本中,SENP7的表达水平更高。文章总结道,SPOP通过降解SENP7促进细胞衰老,由此起到肿瘤抑制子的作用。
-
精英视角

-
技术原理
-
项目成果
-
科技前沿












