中美学者最新Science文章解析蛋白产物之谜
距离人类基因组序列的测序完成已经过去几十年了,但是我们对于基因的一些功能依然知之甚少,一些我们认为已经了解了很多的基因会出现一些可变剪接,导致编码出科学家们之前并不认知的蛋白,完成一些未知的功能。
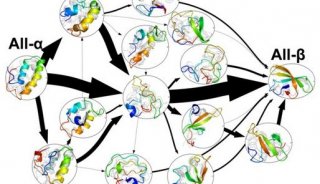
来自香港科技大学,美国Scripps研究所等处的研究人员发表了题为“Human tRNA synthetase catalytic nulls with diverse functions”的文章,针对一种关键的基因家族展开研究,证明了非酶作用的可变剪接也许更为常见,这会改变我们熟知的基因,产生具有其它多元的、功能先前没有被认识到的蛋白。
这一研究成果公布在7月17日的Science杂志上。
氨酰tRNA合成酶(AARS)是一类在蛋白质合成过程中起着重要作用的酶,它通过与 tRNA及其相应氨基酸的专一性识别作用,使得基因序列能够被精确地翻译成蛋白质。一旦氨基酸被传递给tRNA,就可以按照DNA蓝图进行蛋白质翻译,之前的研究表明,AARS酶的可变剪接可产生具有新功能的全新AARS蛋白。
在这篇文章中,研究人员聚焦于AARS基因,分析其可变剪接后出现的蛋白版本,结果他们发现了许多不同形式的蛋白产物,其中大多数失去了将氨基酸被传递给tRNA的功能。
有趣的是,研究人员发现如果令这些AARS片段过量表达,那么就会导致出现不同的细胞活性,这表明这些片段能完成独特的功能,这些功能与之前所知的AARS经典功能不同。
这项研究表明即使是我们熟知的基因,也能产生具有其它多元的、功能先前没有被认识到的蛋白。
氨基酰-tRNA合成酶(AARS)的催化特异性对遗传信息的准确传递十分重要。亮氨酰-、异亮氨酰-及缬氨酰-tRNA合成酶(LeuRS, IleRS, ValRS)通过“转移后编校”水解错误的氨基酰化产物。这类aaRS的编校结构域是插入活性中心称为CP1(Connective Peptide 1)的插入肽段。
之前的研究表明来源于原始的超嗜热菌Aquifex aeolicus的LeuRS(AaLeuRS)能编校这一类酶催化产生的氨基酰化产物或误氨基酰化产物,例如Ile-tRNAIle, Val-tRNAIle, Val-tRNAVal, Thr-tRNAVal和Ile-tRNALeu。
一组研究人员设计了携带三重识别元件的RNA小螺旋(minihelixLIV)以模拟原始的tRNA,研究了AaLeuRS,大肠杆菌IleRS和 LeuRS, 枯草杆菌ValRS单独的CP1肽段编校误氨基酰化小螺旋的能力。结果表明只有AaLeuRS单独的CP1肽段可以水解误氨基酰化的小螺旋,例如Ile -minihelixLIV, Val-minihelixLIV 和Thr-minihelixLIV,而IleRS及ValRS的单独的CP1肽段则不能。这些结果说明AaLeuRS可能有着比IleRS及ValRS 更为原始的编校特性,其编校结构域可能保留了三种酶共同的祖先编校结构域,它应当具有非专一性的编校功能。
-
焦点事件

-
焦点事件
-
焦点事件