漫谈单细胞测序及其临床应用
一、概述
随着现代生物学的发展,细胞群体的研究已不再能满足科研需求。单细胞测序解决了用组织样本测序或样本少时无法解决的细胞异质性难题,为科学家研究解析单个细胞的行为、机制、与机体的关系等提供了新方向。单细胞测序正在成为科研热点。
二、单细胞测序倍受青睐的原因
人们最初以为一个细胞类群是均质的(即各细胞都是相同的)。但是经过研究发现这个细胞类群其实是异质的,在表象和功能上都可以区分为不同的细胞亚群。继续深入研究后发现细胞亚群也是异质的,如此循环往复不断细分。直到今天,我们已经知道:即使来源相同的单个细胞,由于随机生物过程和环境扰动的原因,彼此在许多方面也存在差异,即细胞的异质性。另外,细胞的一切功能,都是由遗传物质的载体,DNA,经过复杂的调控机制表达出mRNA后,再合成出蛋白质而实现的。如按生物学功能及生物标志物对细胞进行区分,推向极致就是按单个细胞之间的基因组和(或)转录组差异进行区分。单细胞测序就是观测单个细胞之间基因组和转录组差异的强大技术手段之一。
三、单细胞测序目前主要的应用领域
哪些领域需要把细胞亚群的鉴定精确到单细胞水平呢?
首先,人体的生殖细胞:精子和卵子。它们每个细胞之间都是互不相同的。但由于缺乏先进的技术手段,我们难以研究它们之间差异的细节,更难以利用它们之间的差异使人类受益。
生殖细胞研究里程碑式的进展发生于2012年,单细胞测序技术的首次应用尝试就是对单精子基因组的研究观察。结果发现,在精子生成的减数分裂过程中,分别来源于父母的两条同源染色体之间会发生重组。所以,每一个精子中的每一条染色体都带有程度不等的父源和母源DNA成份,这也赋予了后代近乎无限的多样性。
只携有单倍体基因组的单个精子都可以测序,那么卵子应该也可以测序。由受精卵发育成的卵裂球、囊胚更应该可以测序。自此,一系列单细胞测序技术在辅助生殖(试管婴儿)中的应用被建立起来,显著地提高了试管婴儿成功率,并可避免单基因遗传病患儿的出生。这是单细胞测序在现实应用中走得最快的一个领域。
另一项被人关注到单细胞层面的重大命题是恶性肿瘤。近期研究发现,即使是同一块肿瘤组织里面的肿瘤细胞也各不相同,存在着高度异质性。同时,恶性肿瘤难以对付的,诸如侵袭、复发、远程转移等各种特性,其实主要是由数量上占极少数的一些肿瘤细胞亚群导至的。通俗地说,一个恶性肿瘤中的极少数肿瘤细胞比其它同类更‘恶’!有科学家把这类细胞称作‘肿瘤干细胞’。
医学科研工作者们在千方百计地寻找药物和疗法克服恶性肿瘤,当然要把矛头对准这些更‘恶’的罪魁祸首才能事半功倍。但是,这些更‘恶’的肿瘤细胞是跟其它肿瘤细胞混在一起的并且占比很少,如何把它们鉴别出来呢?大家首先想到的是通过细胞表面标志物来区分,但效果很不理想。随着高通量测序技术的发展,极大提高了从将近三万个基因的基因组或转录组中鉴别‘恶’细胞的能力。而要想精准观测‘恶’细胞的特征,当然是把他们进行单独检测,以避免互相之间的干扰。单细胞测序是最理想的研究手段。
四、单细胞测序的技术瓶颈
二代测序是一项威力强大的检测新技术。将其应用于单细胞的检测,关键难点并不在于测序本身,而在于单细胞中的核酸物质太少!少到远远不足以直接测序检测的程度。具体来说,一个单细胞中仅含有大约4 - 6 皮克DNA,而二代测序通常要求百纳克级的DNA起始量,二者之间有几十万倍的差距!所以,单细胞测序的关键技术瓶颈是首先要对单细胞中极微量的DNA进行高质量、大幅度的扩增。
全基因组的微量DNA扩增(Whole Genome Amplification,WGA)技术在分子生物学领域已有二、三十年的发展史,但为什么单细胞测序仅仅在几年前才实现呢?是因为经典的WGA技术原理,比如多重置换扩增(Multiple Displacement Amplification,MDA)、简并寡核苷酸引物PCR(Degenerate Oligonucleotide Primer PCR,DOP-PCR)等,存在局限性,使其难以高质量地实现大幅度的DNA扩增。所以,直到一项新原理的WGA技术,即多次退火环状循环扩增技术(Multiple Annealing and Looping-based Amplification Cycles,MALBAC)出现后,稳定可靠的单细胞测序才实现了技术突破。
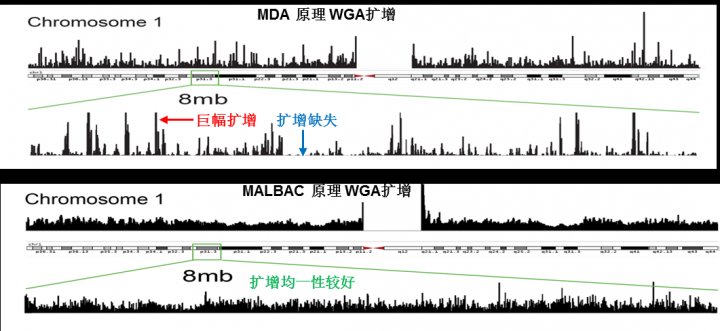
衡量单细胞WGA产物的质量有两个至关重要的指标:均一性和脱扣(Allele Drop Out,ADO)率。均一性指的是扩增幅度的均匀性。图1直观地展示了从两种WGA方法获得的扩增产物的均一性差异。在MDA产物中,染色体上有多处位置获得了巨幅扩增,但也有些位置根本没有获得扩增。这样的扩增效果显然会给下游检测带来麻烦,甚至虚假的结果。而MALBAC扩增产物的均一性有了很大改进,染色体上的所有位置都得到一定程度的扩增。这样的扩增产物在下游检测,特别是在基因(或染色体)拷贝数变异(Copy Number Variation,CNV)检测中效果会好得多。
图1. 两种WGA方法扩增产物均一性比较。图片引自Genome-wide detection of single-nucleotide and copy-number variations of a single human cell.[J]. Science, 2012, 338(6114):1622-1626. 图中的中文注释为本文作者后加。
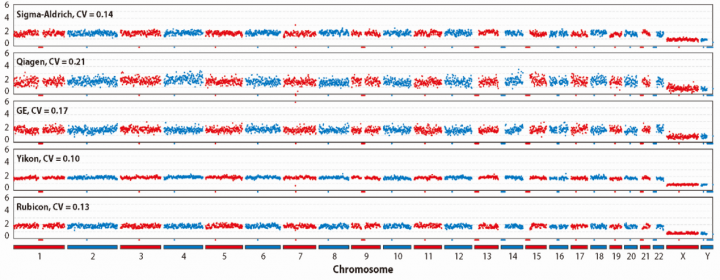
图2展示了几种不同WGA产品对单细胞DNA做扩增测序后,观察(正常人)染色体CNV情况。图中可见:扩增均一性比较好时(Yikon,基于MALBAC原理),CNV图中的点比较密集,各染色体(在两拷贝位置)表现近似一条细线,可以观察出较细微的CNV变异。而扩增均一性较差时(Qiagen,基于MDA原理),CNV图中的点比较离散,形成的染色体线条较粗,细微的CNV变异就可能会被淹没在‘背景噪声’之中。
图2. 几种WGA产品对单细胞DNA做扩增测序后观察(正常人)染色体CNV的对比。图片引自Single-Cell Whole-Genome Amplification and Sequencing: Methodology and Applications. Annu Rev Genomics Hum Genet. 2015;16:79-102
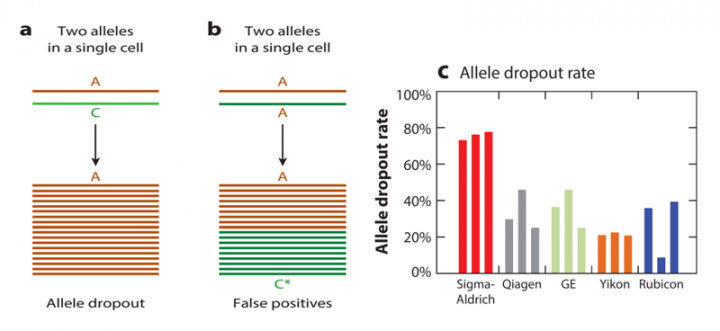
脱扣,指的是不完美的单细胞WGA给下游检测带来的另一种风险。图3直观地展示了这种风险。因为单细胞扩增的起始模板只有一个拷贝的基因组,也就是说每个位点的扩增起始模板只有两个分子(因为人是二倍体生物)。一旦在扩增过程中发生错误,后续检测就会把一个杂合位点误认作纯合位点(图3.a)。反之,也会把一个纯合位点误认作杂合位点(图3.b)。图3c展示了几种WGA产品在进行单细胞扩增时脱扣率的对比情况。图中可见,在这几种产品中脱扣率最低的约为21%(Yikon),最高的可达76%(Sigma-Aldrich)。
脱扣率在单细胞SNP的检测中至关重要,如果脱扣率过高,所得结果的可靠性就很低。以SNP为依据的单倍型判断的可靠性也会很低。这对肿瘤、生殖相关的检测都是很不利的。
图3. 单细胞基因组扩增中的脱扣现象与几种产品导至的脱扣率。a:单细胞WGA导至的脱扣。b:单细胞WGA导至的假阳性结果。c:几种WGA产品单细胞基因组扩增脱扣率的比较。图片来源:Single-Cell Whole-Genome Amplification and Sequencing: Methodology and Applications. Annu Rev Genomics Hum Genet. 2015;16:79-102
理想的单细胞全基因组扩增当然是基因组上各位点都得到同等大幅度的扩增,而且脱扣率为零。但很遗憾,现在还没有哪种技术能够做到这一点。另一方面,新型的WGA技术,比如MALBAC,虽然仍不完美,其单细胞全基因组扩增质量已足以满足部分科研和临床应用需求。事实上,正是因为MALBAC技术的发明,前述具有里程碑意义的单精子测序研究才得以实现。
五、单细胞测序的类型与技术流程
单细胞测序大体上可分为两类:DNA测序和RNA测序。
DNA测序:以高通量测序观测基因组DNA水平的各种变化,包括大至染色体小至几Kb片段水平的拷贝数扩增或缺失,点突变(SNP),融合,重组等等。
RNA测序:观测mRNA(转录组)水平的变化,包括各基因表达产物的剪接情况,各种剪接体的相对占比和绝对数量等等。
单细胞测序的技术流程大致包括:
单细胞挑取,可以人工在显微镜下操作,也可以使用自动化的分选仪器。
细胞的裂解和DNA扩增。RNA测序在扩增前要有一个逆转录过程。
扩增产物的建库,可以有各种建库方法。建库步骤也可以与前一步的DNA扩增步骤合二为一。
上机测序,可以有不同读长、单端或双端测序等选择。
数据分析,策略与方法因检测目的不同而异。
从技术流程上讲,两类单细胞测序的主要差异在于:RNA测序在细胞裂解后,DNA扩增前多了一个逆转录步骤,先把mRNA转化成cDNA。后续的扩增、建库、测序步骤大同小异。最后的数据分析步骤依不同的应用目的各不相同。
六、单细胞测序的临床应用:现状与未来
单细胞测序技术使以前想做但很难做,甚至无法做的科研与临床应用成为现实。其开山之作,单精子的测序研究就很好地展示了这一点。随后,基于MALBAC扩增技术的单细胞测序被应用于第三代试管婴儿:胚胎植入前筛查(Pre-implementation Genetic Screen,PGS)与诊断(Pre-implementation Genetic Diagnosis,PGD),成为单细胞测序技术建立最早,发展最快的临床应用。
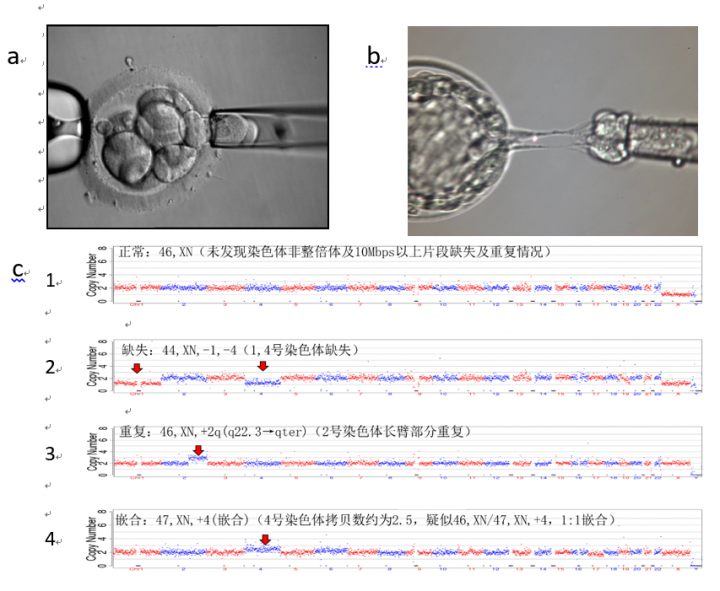
常规试管婴儿流程中,胚胎选取的标准主要是显微镜下的形态学观察,经常无法反映胚胎真实质量,成为限制试管婴儿成功率(平均只有40%左右)的瓶颈之一。利用单细胞测序技术,从各胚胎中分别捡取1 – 3个细胞(图4. a,b)进行基因组检测(即PGS),即可判断哪个胚胎是最优质的(图4.c)。将优质胚胎植入母体即可显著提高成功受孕的机会。
如果夫妇二人都是某种常染色体隐性单基因遗传病的缺陷基因携带者(比如遗传性耳聋),或有一方是常染色体显性或X-连锁隐性单基因遗传病患者(比如多发性骨软骨瘤、假肥大性肌营养不良),则可以在PGS基础上,在测序时对各胚胎中父亲和(或)母亲所携致病位点的相应区域做详细检测(即PGD)。根据检测结果,只将不携有致病缺陷的胚胎植入母体子宫,即可保证未来婴儿的健康。PGD技术不仅避免了遗传缺陷患儿的出生。更重要的是,从这个婴儿开始,其家族中导至该疾病的基因缺陷被彻底消除,该遗传病在其家族中的世代传递将被阻断。
从实验技术上讲,单细胞测序的本质特征是对极微量核酸的测序检测。所以单细胞测序检测技术可以拓展到几乎所有涉及极微量核酸测序检测的其它应用。比如,在试管婴儿受精卵成长为囊胚的体外培养过程中会有极微量的胚胎DNA进入培养基,利用MALBAC技术将这些微量DNA扩增、测序及分析CNV后,可用该结果来反映对应胚胎的CNV情况。 这种方法被称为无创胚胎染色体筛查技术(NICS:Non-invasive Chromosome Screening)。NICS避免了对卵裂球或囊胚的活检取样,从而避免了破坏胚胎的风险。
目前,第一例NICS试管婴儿已经健康出生。如果正在进行中的多中心临床研究表明这一技术确实有助于提升试管婴儿成功率,则NICS必将成为未来PGS检测的发展方向。
图4. 胚胎活检及PGS检测结果。a:受精卵培养第三天时从卵裂球中吸取一个细胞活检。b:受精卵培养第五天时从囊胚外滋养层吸取 3-5个细胞活检。 c:单细胞测序检测4个胚胎的染色体的CNV示意图:只有1号胚胎的染色体正常,可选择植入母体子宫。
当前,单细胞测序,特别是单细胞RNA测序在肿瘤方面的应用基本还处于学术科研层面,执行诸如鉴定肿瘤细胞亚群,搜寻肿瘤干细胞之类的任务。与临床比较接近的一类应用是对循环肿瘤细胞(Circulating Tumor Cells,CTC)的鉴定。CTC是从恶性肿瘤原发灶脱落,进入血液循环的肿瘤细胞,是恶性肿瘤远程转移的罪魁祸首。CTC的分离鉴定,对恶性肿瘤的早期诊断,伴随诊断和复发诊断均有潜在的重要意义。现有CTC的鉴定手段多局限于对几个上皮来源肿瘤表面标志物,如CK,EpCAM的免疫组化检测和针对8号染色体拷贝数扩增的FISH检测。这些标志物检测的共同缺陷是:它们都只在部分CTC中存在。那些细胞表面不存在这些标志物,或8号染色体数目没有发生异常的CTC必然成为漏网之鱼。另外,即使依靠细胞表面标志物检出了CTC,所能提供的信息最多不过是CTC的数量,无法回答临床极为关注的更多问题,如,肿瘤的原发灶在哪里?肿瘤对哪种靶向药物有效或无效?复发的肿瘤与原发肿瘤是否有着相同的药敏特性等等。理论上说,单细胞测序则可以在一个检测中回答所有这些问题。当然,真正现实可行的临床检测方案尚在襁褓之中,希望在不久的将来有所突破。
单细胞测序的对极微量核酸测序检测的这一特征,在临床微生物检测中的用武之地已受到一定关注。有些致病菌体外培养困难,生长周期很长(比如,结核杆菌的培养周期达一个月)。有些甚至尚无法做体外培养(比如梅毒螺旋体)。利用从患者体内获取的极微量细菌,不经培养,利用单细胞测序的拓展技术直接进行感染的早期诊断和耐药(药敏)检测极具临床价值。
七、当前单细胞测序的技术局限性和发展方向
如前所述,目前尚不存ADO率为零,扩增均一度100%的理想的单细胞DNA扩增方法。因此,单细胞DNA测序也就远非完美。
在某些应用中,比如PGD,因为可以有父母样本、先证者样本做参考,即使存在一定的ADO率,也可以利用巧妙的技术策略,将检测从点突变的观测转化为对胚胎染色体单倍型的鉴定,从而填补单细胞DNA扩增的不完美,确保检测结果的正确性。但在肿瘤相关的单细胞测序中,比如CTC的测序检测,很重要的一类检测是发现体细胞点突变。此时的检测目标与细胞染色体的单倍型无关,没有可供矫正检测错误的参考,其正确性只能依赖于扩增过程中的低ADO率。
同样,在某些应用中,比如CNV检测,扩增的不均一性可以用增大测序数据量等技术手段在一定程度上予以弥补。但在另外一些应用中,比如单细胞RNA的转录组测序,对cDNA的不均一扩增所导至的检测结果偏倚,即使再大的测序数据量也无法纠正。所以,持续改善单细胞DNA扩增质量是进一步拓展单细胞测序技术应用范围的必然要求。
现有单细胞RNA测序的技术方法多数是针对带有polyA尾巴的mRNA的。对已经被广为关注的microRNA,lnRNA等的单细胞测序尚没有建立很有效的方法。同样,对基因组甲基化和当前受到高度关注的等位基因之间差异甲基化的单细胞测序检测技术也有待发展。
八、结语
随着单细胞扩增技术的不断完善及测序手段的不断进步,我们有理由相信单细胞测序技术不仅将在生命科学研究的大海中风生水起, 一展身手,也会给人类对抗疾病、保障健康和提高生命寿命和质量带来很多新的机会。