免疫共沉淀技术
免疫沉淀可用于定位甲基化或转录因子结合的位置等DNA变化,但可能需要与假抗体进行斗争。
尽管ChIP-seq、DIP-seq和相关技术可以提供全基因组测定的相关信息,但它们并非总是有效。
染色质免疫沉淀(chromatin immunoprecipitation, ChIP)或DNA免疫沉淀(DNA immunoprecipitation, DIP)结果有误,并不是偶发事件。ChIP是间接表征基因功能的一种试验技术。为了找到转录因子(transcription factor, TF)或组蛋白标记与待研究基因组的结合位点,实验室可能会选择ChIP-seq方法,使蛋白质和DNA发生交联,然后剪切染色质,用识别待研究的转录因子或组蛋白标记的抗体进行免疫沉淀,然后对与转录因子或组蛋白结合的序列进行测序。DIP-seq可用于定位DNA变化,例如甲基化。林雪平大学(Linköping University)的研究员Colm Nestor表示,ChIP-seq和DIP-seq一直是“表观遗传学研究的基石”,该领域基于这两种方法从基因特异性表观遗传学转向了全基因组的表观基因组学。他表示,这两种技术都很便宜,相对容易实施,并且“在正确实施的情况下,结果非常稳定”,因此被广泛使用。
ChIP-seq实验中使用的抗体很多时候并不像实验室设想的那样具有特异性。一些基因组位点可能非常“粘”,粘住了其它蛋白,或在某些条件下,失去“粘性”,没有粘住特定蛋白。正如丹娜法伯癌症研究院(Dana Farber Cancer Institute)的研究人员Xiaole Shirley Liu和Clifford Meyer指出的那样,ChIP-seq潜在的一些偏差在于抗体特异性缺失问题、染色质剪切问题、交联问题或测序问题。为了对抗ChIP-seq和DIP-seq伪迹,排除实验性故障是不可避免的。 尽管一些故障并不是抗体的锅,但是当实验室进行故障排除时,一定要优先考虑抗体的特异性。以下是两个免疫沉淀(immunoprecipitation, IP)故障案例,两家抗体公司的研究人员对此评论了ChIP-seq和DIP-seq技术面临的挑战。
ChIP-seq数据可靠性受质疑
ChIP-seq使科学家能对整个全基因组进行分析,因为利用该技术,正如慕尼黑大学(Ludwig Maximilians University)的研究员Peter Becker所指出的,能够“在整个基因组的背景下,展示成千上万的结合位点。例如,通过比较多次实验的ChiP-seq数据,研究者可以产生关于不同结合的生理功能的假说。他的前博士生、现在在哈佛大学(Harvard University)Peter Park实验室做博士后的Dhawal Jain表示,ChIP-seq实验在功能基因组学中是必不可少的,因为其能提供转录因子的生理功能的重要信息。他在表征任何新型DNA结合因子时,都会选ChIP-seq作为首选实验,并且获取“高度可信”的数据至关重要。他和Becker都对他们的数据的可靠性感到不安。
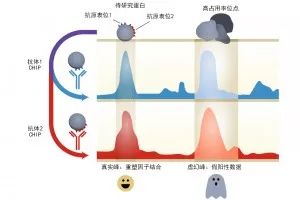
当Jain还在Becker实验室读博时,他们正在研究核小体重塑。核小体是DNA及缠绕着DNA的组蛋白组成的复合物,核小体重塑复合物在某些DNA位置打开转录“窗口”。重塑复合物与DNA的相互作用往往在瞬间完成,因此很难捕获和表征。Jain表示,通过使用针对这些重塑因子的抗体开展ChIP-seq实验,该团队希望找到较宽的信号峰。他们非常惊讶地发现,在不存在核小体的染色区域,居然也有很窄的信号峰。Jain还指出,这些信号对他们来说是惊人的。
他们调查并鉴定了大约3000个具有非特异性ChIP富集的基因位点。为了验证实验结果,他们敲除了重塑复合物的2个因子,并得到了类似的ChIP-seq结果。他们发现了假阳性信号:虚幻峰(Phantom Peak)。这些虚幻峰影响了他们的数据质量,并可能影响了许多实验室和数据库中的数据。Becker表示,大多数虚幻峰位点都处于启动子位置,其中许多蛋白质与无序结构域结合,非特异性抗体结合可能是罪魁祸首。Becker还提醒,虚幻峰峰值比较低,通常在具有强烈特异性特征的实验中被忽视。但是一旦你的ChIP反应由于各种原因效率低下,并且你的特定峰值很低,那么虚幻峰就会出现。该团队建议谨慎地解读ChIP-seq峰值。Becker等人在自己的论文中列出了虚幻峰列表,为他人提供参考。为了排除虚幻峰,他们建议进行敲除或敲减实验。Jain认为,如果目标分子过于重要,敲除或敲减可能不可行。Becker则指出,输入控制可能会有所帮助。
即使实验室通过蛋白质印迹(western blots, WB)和免疫荧光(immunofluorescence, IF)确定了抗体特异性,非特异性结合也可能成为问题。该团队也遇到了这样的问题。Jain表示,非常棘手的一个问题是,在一种验证试验中起作用的抗体在另一种验证试验中可能不起作用。然后,实验室尝试使用WB或IF验证抗体的特异性,并尝试使用正交抗体重现ChIP-seq谱。但正交生成的ChIP-seq数据不一定能消除虚幻峰。他们还发现,使用完全不相干的抗体,如抗GFP,也能得到ChIP-seq富集信号。Jain指出,总的来说,人们越来越意识到基因组的某些区域无法通过ChIP实验检测,只会得到假阳性数据。Becker表示,研究重塑因子,尤其是ACF1和RCF1时遇到的一个问题是,由于它们与DNA的相互作用是瞬时的,因此无法很好地与染色质发生交联。从根本上说,他们实验中用的抗体质量很好,但还是存在非特异性结合。从最开始,他们就给ACF1添加了一个DNA结合域,使其连接到DNA,最好可以对其进行ChIP分析。从本质上来讲,该问题还是与抗体的非特异性结合有关。
ChIP-seq数据可能会出现“虚幻峰”,这些“虚幻峰”与待研究蛋白并不对应。使用两种正交抗体进行验证可以排除这种假信号。但这并不总能奏效。例如,抗体可能非特异性地结合与开放染色质互动的蛋白质。
DIP-seq的致命BUG
林雪平大学(Linköping University)的Nestor表示,基于抗体的技术可用于研究新发现的表观遗传变化,如N6-甲基腺嘌呤,因为生产靶向这些表观遗传变化的抗体并不困难。因此,研究人员不必每次在检测到新的表观遗传标记时都必须开发特异性检测该修饰的方法。Nestor有十多年的DIP-seq经验,先免疫沉淀富集高甲基化的DNA片段,然后对其进行测序。Nestor、他的博士生Antonio Lentini和团队中的其他人并没有预想到DIP-seq技术也存在漏洞,但事情就是这样不凑巧。据该团队称,DIP-seq数据中50%至99%的富集区域可能是误报。他们发现了一个基因组区域的非特异性富集,该区域被称为短串联重复序列(short tandem repeat, STR)。其它已知的伪信号来源包括:实验室主要使用的5-甲基胞嘧啶(5-methylcytosine, 5mC)抗体优先富集低CG含量的基因组区域,最常用的5-羟甲基胞嘧啶(5-hydroxymethylcytosine, 5hmC)抗体在基因组的高度修饰区域也是如此。
在对已发表的DIP-seq研究的分析中,他们发现低丰度基因组修饰,如5-甲酰基胞嘧啶和5-羧基胞嘧啶具有最高的假阳性率。他们一直在研究这些修饰以探索DNA甲基化在人类T细胞中的作用。他们在免疫球蛋白G(IgG)对照组中注意到“特殊的”结合模式。他们发现,多达95%的已发表作品不包括IgG对照组。Nestor指出,他一直使用DIP-seq技术,而没有适当设置IgG对照组,因此他也没有立场指责其他人。
该团队用缺乏5mC和5hmC修饰的胚胎干细胞验证了他们的结果。抗体仍与STR位点结合。也许单链DNA会与IgG抗体结合。Lentini推测STR结合可能提供功能性线索,并且可以设计出能抑制这种结合的抗体。他指出,在此之前,我们最好的选择是了解这些问题并控制它们。该团队表示,避免假阳性,并纠正这种观察到的脱靶结合,最好的方式是设立IgG对照组,这可以将信噪比提高三倍,实验室可以因此检测出更微妙的DNA修饰变化。Nestor表示,“输入”是DIP试验的标准对照,一般指的是pre-IP的染色质样品。作为一名博士后研究员,他记得曾有人建议他避免使用IgG做对照,因为它们会给实验增加太多噪音。但研究人员表示,输入是一种高度不一致的对照组,并且DIP-seq极大地高估了哺乳动物基因组中的5-modC修饰。虽然Nestor和其他人使用计算工具来过滤DIP-seq数据,但他担心数据集中本身就自带大量错误。
另一个挑战是细菌污染。通常感染支原体和大肠杆菌的细胞培养物显示出高水平的N6-甲基腺嘌呤(N6-methyladenine, 6mA)修饰,该修饰在哺乳动物中很少见,但在微生物中很常见。 Nestor指出,6mA仍然是一个谜。它很难被发现,没有一种技术可以在哺乳动物中可靠地检测到它,因此它仍然是一个需要探索的难题。他想知道“6mA这个神秘的DNA修饰的功能到底是什么” 。巴斯大学(University of Bath)的Andrew Chalmers建议,当科学家选择实验(包括ChIP-seq实验)用的抗体时,可以看看他人在相关试验中使用过的试剂。Chalmers共同创立了CiteAb网站——一个在线资源,用于查找有关抗体的已发表文献和公司信息。他表示,关于抗体验证的“五大支柱策略”(注:国际抗体验证工作组为验证抗体的特异性提出的5个验证策略,包括基因策略、正交策略、独立抗体策略、标签蛋白的表达和免疫捕获及质谱分析。具体参见https://www.xianjichina.com/news/details_59686.html)并不完美,但它是讨论和分析抗体验证的良好框架。通常情况下,他人的实验可能与你有很大不同,但可用的数据和来自其他人的、来之不易的经验教训可以提供宝贵的参考。
敲除/敲减
抗体公司Abcam的研究和开发团队负责人Velibor Savic表示,抗体实验既有靶向效应,又有脱靶效应。实验人员在ChIP中,也需要减少目标信号。ChIP-seq是敏感的,因此ChIP-seq中的脱靶信号比其它技术更明显。这使得敲除和敲减在ChIP-seq中至关重要。有了这个,从一堆信号中挑出目标并找出正确的峰值会容易很多。
即使是瞬态相互作用也会产生深远的影响。Savic指出,但通过ChIP很难捕捉到这种瞬间互动。目标结果可能会混杂到背景中,因为在给定时间只有一些互动位点被占用。探索稳定住这种瞬时互动的方法非常有用。使用靶标的敲减或功能性敲除能排除脱靶结合和非特异性相互作用。在大多数情况下,这可以很好地确定实验样本中目标蛋白质的位置,以及敲除该蛋白后的背景模式。他认为,ChIP提供的只是DNA交互谱的平均静态图像,而DNA交互是动态的。人们不能从一张静止的图像中判断出一部电影,同样人们也无法从单一的ChIP实验中得出动态的结论。ChIP-seq数据只是提供功能性洞见的第一步。