北大昌增益教授最新文章:ATP合酶作用新机制
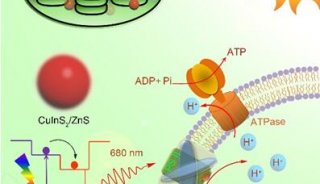
ATP合酶利用跨膜离子(主要是质子)梯度提供的能量, 催化由ADP和Pi(磷酸)合成ATP的反应. 已有证据表明, 这种催化反应通过ATP合酶内部亚基之间的相对旋转而实现. 然而, 现有的基于整合在细胞膜内的c环及附着于其上的中心杆(由e和g亚基组成)转动的ATP合酶旋转模型存在多方面的理论缺陷, 也与某些实验数据不符.
来自北京大学生命科学学院的昌增益教授等人提出了一种新的ATP合酶旋转催化模型, 其中发生旋转的是α3β3六聚体. 具体而言, 质子的跨膜转运引起c环的周期性构象改变, 从而使得附着在c环上的中心杆产生往复运动, 这种往复运动驱动α3β3六聚体的连续转动. 这种工作模式与按压式伸缩圆珠笔中推杆的往复运动驱动凸轮产生连续转动的工作机理十分相似. 新模型不仅避免了现有模型的理论缺陷, 而且更好地解释了已有实验数据.
ATP合酶是一种由多个亚基组装而成的存在于所有生物体内的关键能量转换装置, 它利用细胞膜两侧的离子(通常是质子)浓度差以及电势差所储存的化学能, 合成细胞内的“能量货币”——ATP分子。ATP合酶是一种分子尺度的马达, 催化反应通过一种独特的内部亚基之间的相互旋转机制而实现。认识ATP合酶的工作机制一直是生命科学研究的一个热点问题, 相关工作曾于1978年和1997年被授予诺贝尔化学奖。
尽管ATP合酶的一种传统旋转催化模型已经进入了生物化学的教科书, 但具体究竟哪一部分相对于其所附着的生物膜在旋转一直未能确定。传统模型认为, 当质子通过通道发生跨膜转运时, 将驱动c亚基环在细胞膜内的连续转动, 进而驱使附着在c环上的γε中心杆转动, 后者的转动引起α3β3中的活性中心发生周期性构象改变, 从而催化ATP的合成。然而该传统模型不仅存在诸多理论上的缺陷, 而且与体外通过X衍射等方法获得的该蛋白质复合体的结构信息不符。
北京大学昌增益研究组通过仔细分析已经发表的有关该酶复合物的各类体外实验数据,提出了一种ATP合酶旋转催化的新模型。在新模型中, 发生转动的是α3β3六聚体, 而不是传统模型中所认为的c环/γε中心杆。具体而言, 质子沿通道的跨膜转运(即质子的结合与释放)将造成c环的周期性构象变化, 驱使附着在c环上的γε中心杆发生周期性的往复运动, 后者进而驱动α3β3六聚体的连续转动, 实现ATP的合成。
这种由往复运动转化为圆周转动的模型, 是受到可伸缩圆珠笔的工作模式启发而提出的。新模型更好地解释了已有的实验数据, 并避免了传统模型的严重理论缺陷。这项工作为通过实验, 特别是活细胞内的实验, 来进一步认识ATP合酶的旋转催化提供了一种全新的思路。另外, 论文作者通过综合已有的结构信息还制作出了直观展示该新旋转催化机制的动画。
-
项目成果