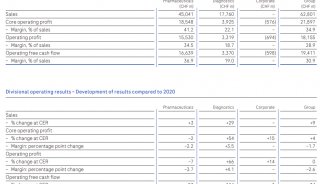
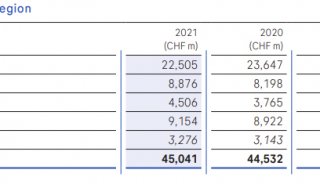
罗氏公布Tecentriq+Avastin组合III期 可显著延长总生存期!
罗氏(Roche)近日在2020年肝癌峰会上公布了III期IMbrave150研究(NCT03434379)的中国队列数据。这是一项开放标签、多中心、随机III期研究,在先前未接受系统治疗的不可切除性肝细胞癌(HCC)患者中开展,调查了抗PD-L1疗法Tecentriq(特善奇,通用名:atezolizumab,阿特珠单抗)与Avastin(安维汀,通用名:bevacizumab,贝伐单抗)联合治疗方案相对于标准护理药物——多激酶抑制剂索拉非尼(sorafenib)的疗效和安全性。该研究中,共入组了194例中国患者。
结果显示,中国队列数据与全球结果一致:与索拉非尼相比,Tecentriq+Avastin联合治疗使总生存期(OS)和无进展生存期(PFS)均显示出统计学意义和临床意义的改善。在中国队列中:与索拉非尼相比,Tecentriq+Avastin联合治疗将死亡(OS)风险降低了56%(HR=0.44,95%CI:0.25-0.76)、将疾病进展或死亡(PFS)风险降低了40%(HR=0.60,95%CI:0.40-0.90)。Tecentriq和Avastin具有良好的耐受性和可管理的毒性,其安全性与每个药物已知的安全性一致。
特别值得一提的是,IMbrave150是在最常见的肝癌——肝细胞癌(HCC)治疗方面显示出改善总生存期(OS)和无进展生存期(PFS)的首个III期癌症免疫治疗研究。Tecentriq与Avastin组合也是十多年来在先前未接受系统治疗的不可切除性肝细胞癌患者中改善OS的首个治疗方案。在美国监管方面,FDA正在通过实时肿瘤学审查试点项目对Tecentriq+Avastin组合方案的补充申请进行审查。之前,该方案已被FDA授予突破性药物资格。在中国,该方案已于最近被中国国家药品监督管理局(NMPA)受理。
罗氏首席医疗官兼全球产品开发主管Levi Garraway医学博士表示:“全球几乎一半的肝细胞癌病例都在中国发现,因此,与中国目前的护理标准相比,接受Tecentriq和Avastin治疗的中国患者具有更长的生存期,这是非常令人鼓舞的。我们正与中国国家药品监督管理局(NMPA)以及全球其他监管机构密切合作,希望尽快将这一治疗方案带给患者。就在最近,NMPA受理了我们的补充生物制品许可申请(sBLA)。”
在全球范围内,每年有超过75万人被诊断为肝细胞癌(HCC),这是最常见的肝癌类型,大多数病例发生在亚洲,几乎一半病例发生在中国。此外,肝癌的发病率在欧洲和美国都在上升,美国的肝癌病例数量自1980年以来增加了两倍多。
罗氏为Tecentriq制定了广泛的开发计划,包括多项正在进行和计划进行的III期研究,涉及多种类型的肺癌、泌尿生殖系统癌、皮肤癌、乳腺癌、胃肠道癌、妇科癌和头颈癌。这包括Tecentriq单独用药或与其他药物联合治疗的研究。
Tecentriq属于PD-(L)1肿瘤免疫疗法,旨在与肿瘤细胞和肿瘤浸润免疫细胞上表达的一种名为PD-L1的蛋白结合,阻断其与PD-1和B7.1受体的相互作用。通过抑制PD-1,Tecentriq可以激活T细胞,该药有潜力作为癌症免疫疗法、靶向药物及各种癌症化疗的一种基础联用疗法。
Avastin属于血管生成抑制剂,靶向结合血管内皮生长因子(VEGF)。VEGF在肿瘤生命周期中的血管生成和维持方面发挥着重要作用。Avastin通过与VEGF直接结合来感染肿瘤的血液供应,防止其与血管细胞上的受体相互作用。肿瘤的血液供应被认为是肿瘤在体内生长和转移能力的关键。
将Tecentriq与Avastin进行联合用药具有强有力的科学依据,Tecentriq+Avastin组合具有增强免疫系统对抗肿瘤的潜力。Avastin除了具有既定的抗血管生成作用之外,还可以通过抑制VEGF相关的免疫抑制、促进T细胞肿瘤浸润以及启动T细胞对肿瘤抗原的反应,进一步增强Tecentriq恢复机体抗癌免疫的能力。
2018年12月,美国FDA批准Tecentriq+Avastin+化疗(卡铂和紫杉醇)一线治疗无EGFR或ALK基因组肿瘤畸变的转移性非鳞状非小细胞肺癌(NSq NSCLC)成人患者。该批准基于IMpower150研究的B组患者数据:在意向性治疗野生型(ITT-WT)患者中,与Avastin+化疗相比,Tecentriq+Avastin+化疗显著延长了患者的生存期(中位OS:19.2个月 vs 14.7个月,HR=0.78,p=0.016)。