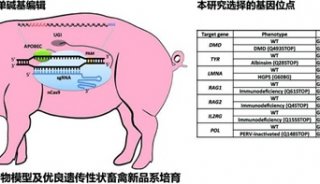
新突破:把突变蛋白“变成”健康蛋白的基因治疗方法
今日最新一批《自然》论文如期上线,其中来自CRISPR领域大牛刘如谦(David Liu)教授团队的一篇论文引起医药行业的关注。使用单碱基编辑方法,该团队提供了一种进行基因治疗的全新思路,有望打开罕见遗传病治疗的全新天地。
这项研究针对的是镰刀型细胞贫血病(sickle cell disease,SCD)。这是一种常染色体显性遗传病,病因相当明确——由于基因突变,患者体内无法产生正常的血红蛋白。目前,已有多家生物医药公司正在开发治疗这种疾病的基因疗法:一些公司想把编码正常血红蛋白的基因引入患者体内,重塑患者制造这些血红蛋白的能力;另一些公司则另辟蹊径,想要恢复人体产生胎儿血红蛋白的能力。这种血红蛋白也具有运输氧气的能力,但往往在婴儿期就停止了生产。
无论是哪一种方法,在临床试验中都已经取得了不错的结果,且能实现对SCD的功能性治愈。但这些方法要么使用慢病毒作为基因载体,要么使用CRISPR技术,这些理论上都有可能带来潜在的治疗风险,比如基因插入到染色体的随机位置,破坏抑癌基因的功能,或是造成DNA双链断裂,导致意外的染色体重排。目前,科学家们还没有在临床试验中观察到这些现象,但终究存在理论上的隐患。
本论文则提供了一种全新的思路。SCD是一种单碱基突变导致的疾病,病因在于一个腺嘌呤(A)突变成了胸腺嘧啶(T)。早在几年前,刘如谦团队就已经开发出了单碱基编辑技术,在不弄断DNA双螺旋的情况下对碱基进行精准的编辑。但很遗憾,这种工具尚有局限,不能反其道而行之,把T变回成A。
从印度尼西亚的一个罕见血红蛋白变异体中,研究人员们找到了新的思路。这个变异体的腺嘌呤突变成了胞嘧啶(C),但依旧可以维持血红蛋白的正常功能。而将T修改成C,是可以通过单碱基编辑实现的。
在人类细胞中,研究人员们进行了概念验证。他们从SCD患者体内分离出了造血干细胞和祖细胞,进行单碱基编辑,发现能将80%的突变血红蛋白变为具有功能的变异血红蛋白。研究人员们也将这些干细胞移植入免疫缺陷的小鼠体内。16周后,具有功能的变异血红蛋白依旧占有68%的比例,且小鼠相应症状减少了5倍,表明单碱基编辑取得了持久的治疗效果。
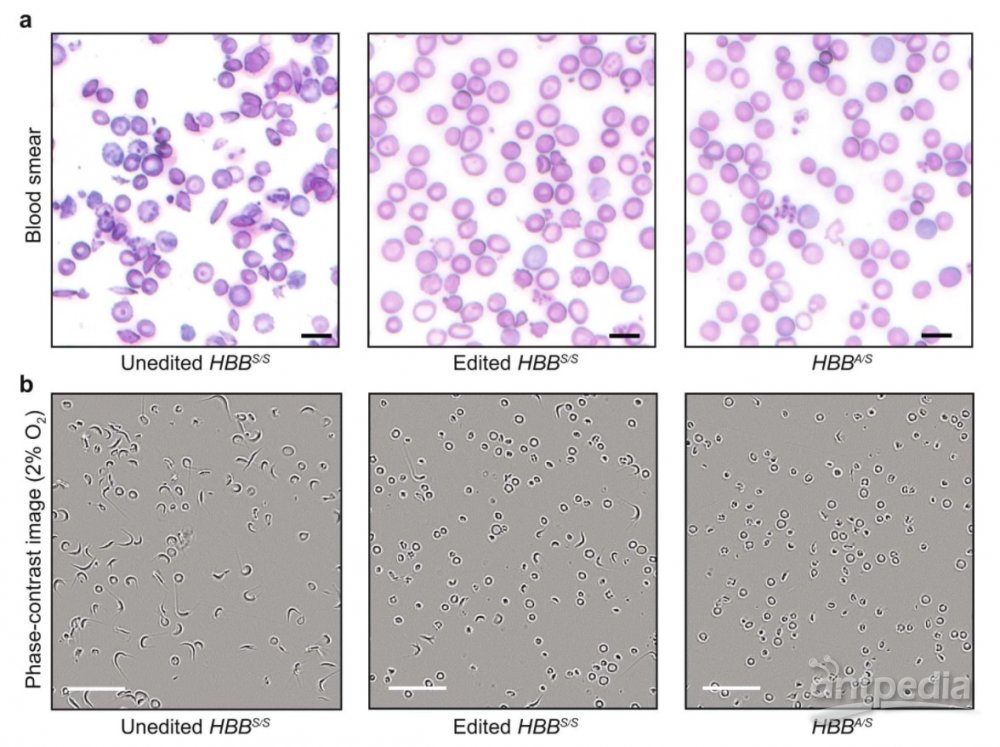
▲对小鼠造血干细胞进行单碱基编辑,可以逆转它们的症状
在另一个实验中,研究人员们从人源化的SCD小鼠模型中分离出造血干细胞和祖细胞,进行单碱基编辑,再把这些细胞输入经过辐照处理的小鼠体内。同样是在16周后,这些小鼠的血液里,79%是具有正常功能的变异血红蛋白。类似的,这些小鼠的症状减轻了3倍。综合来看,这些小鼠的血液学参数也接近正常。
注:原文有删减