Science:徐华强等揭示甲状旁腺激素受体-1结构及其动态性
甲状旁腺激素受体-1(PTH1R)是一种B级G蛋白偶联受体,是钙稳态的中心,是骨质疏松症和甲状旁腺功能减退症的治疗靶点。 然而,全长PTH1R与功能性肽激素相互作用并与下游G蛋白偶联的结构基础仍然未知,这是临床相关PTH类似物的发展和理解GPCR信号传导的基本机制的障碍。
2019年4月12日,中科院上海药物所徐华强,王明伟,浙江大学张岩及匹兹堡大学医学院Jean-Pierre Vilardaga共同通讯在Science发表题为“Structure and dynamics of the active human parathyroid hormone receptor-1”的研究论文,该研究报告了人类PTH1R与长效PTH类似物和刺激性G蛋白结合的冷冻电子显微镜结构。 结合的肽采用延伸的螺旋,其氨基末端深入插入受体跨膜结构域(TMD),导致跨膜螺旋6的羧基末端部分解旋并在该螺旋中间诱导尖锐的扭结以允许受体 与G蛋白结合。 与单个TMD结构状态相反,细胞外结构域采用多种构象。 这些结果提供了对PTH结合和受体激活的结构基础和动力学的见解。
总而言之,该结构模型有助于解释甲状旁腺激素如何与其受体相互作用以及受体激活的分子基础。

甲状旁腺激素(PTH)和PTH相关肽(PTHrP)是两种内源性配体,在骨骼发育,钙稳态和骨转换中起着关键和独特的作用。 PTH和PTHrP的类似物已被开发成骨质疏松症的治疗剂,并且PTH用于治疗甲状旁腺功能减退症。此外,肿瘤产生的PTHrP是驱动癌症相关的高钙血症和恶病质的关键因素,其与体重减轻病症相关并且经常是癌症患者的实际死亡原因。因此,调节PTH-PTHrP信号传导轴对于许多疾病(包括骨质疏松症和癌症)的治疗的开发是重要的。

与Gs复合的LA-PTH结合的人PTH1R的Cryo-EM结构
PTH和PTHrP的多效功能主要通过它们与PTH 1型受体(PTH1R)的结合和活化来介导,PTH 1型受体是BG蛋白偶联受体(GPCR)亚家族的成员,其也包括胰高血糖素受体,胰高血糖素样受体,(GLP),降钙素,降钙素基因相关肽(CGRP)和其他治疗上重要的肽激素。 PTH1R主要与刺激性G蛋白(Gs)偶联,G蛋白被认为是响应PTH的骨转换和钙稳态的主要介质。
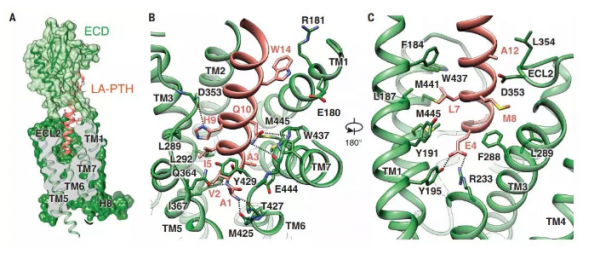
PTH1R对LA-PTH的分子识别
PTH1R含有两个模块结构域:相对大的N-末端细胞外结构域(ECD)和跨膜结构域(TMD)。通过肽激素的C末端区域与受体ECD的快速结合,然后将肽的N-末端区域缓慢插入受体的TMD,启动PTH1R的激活。肽激素结合触发介导受体活化的TMD的构象变化。然而,全长PTH1R与功能性肽激素相互作用并与下游G蛋白偶联的结构基础仍然未知,这是临床相关PTH类似物的发展和理解GPCR信号传导的基本机制的障碍。
最近在冷冻电子显微镜(cryo-EM)方面的技术进步已经彻底改变了GPCR结构生物学的进展,产生了一系列突破性结构,包括与G蛋白复合的几种A类和B类GPCR。然而,B类GPCR及其肽配体的氨基酸序列在亚家族内显著不同,因此配体结合特异性的基础仍然未知。
该研究报告了人类PTH1R与长效PTH类似物和刺激性G蛋白结合的冷冻电子显微镜结构。 结合的肽采用延伸的螺旋,其氨基末端深入插入受体跨膜结构域(TMD),导致跨膜螺旋6的羧基末端部分解旋并在该螺旋中间诱导尖锐的扭结以允许受体 与G蛋白结合。 与单个TMD结构状态相反,细胞外结构域采用多种构象。 这些结果提供了对PTH结合和受体激活的结构基础和动力学的见解。
总而言之,该结构模型有助于解释甲状旁腺激素如何与其受体相互作用以及受体激活的分子基础。
参考信息:
https://science.sciencemag.org/content/364/6436/148




















