国家将提升药品审批标准 "新药""仿制药"被重新定义
“药品审评标准将提高,新药将分为创新药和改良型新药,‘新药’将由现行的‘未曾在中国境内上市销售的药品’调整为‘未在中国境内外上市销售的药品’;仿制药由现行的‘仿已有国家标准的药品’调整为‘仿与原研药品质量和疗效一致的药品’。”在18日召开的国务院新闻发布会上,国家食品药品监督管理总局副局长吴浈表示,药品审评审批将进行全面综合改革。未来科研人员可以不必一次性转让自己的研发成果,而是将创新药变成资本的形式入股、投资以及生产产品直接获益。”
记者了解到,多年来,药品审评审批制度在我国医药产业发展中一直备受批评。数据显示,截至目前,我国等待审评审批的药品多达21000件,申报排队等候现象严重,影响了科研人员积极性和企业的创新投入与发展。
吴浈指出,我国现代制药企业起步较晚,标准偏低。自2000年以来,国家逐步采取将地方审批药品集中到国家统一审批、药品标准由地方标准上升到国家标准、提高GMP认证水平、推进仿制药与原研药质量和疗效一致性评价等措施提高药品质量。但总体上仍然存在药品审评标准不高、管理方式落后、审评审批体制不顺、机制不合理等问题。特别是企业低水平重复申报、部分注册申报临床数据不真实、不完整、不规范等问题比较突出。而我国审评审批人员数量严重不足、待遇较低,也与注册申报需求也不匹配。针对这一现状,近日,国务院印发《关于改革药品医疗器械审评审批制度的意见》(以下简称《意见》),明确了药品和医疗器械审评审批的改革目标、任务和具体措施,其核心就是提高药品质量,建立科学、高效的审评审批体系。
吴浈强调,国家食品药品监督管理总局已订出时间表,将抓紧修订药品管理法实施条例及《药品注册管理办法》,于2016年底之前消化完注册申请积压存量,2018年实现按规定时限审批,全面提高审批透明度,推动医药行业结构调整和转型升级,更好地满足公众用药需要。
-
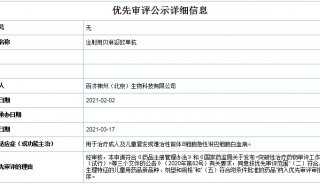
焦点事件

-
焦点事件

-
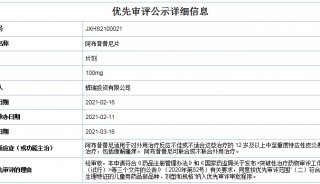
焦点事件

-
焦点事件
-
焦点事件

-
政策法规