蛋白质的圆二色性
一、 蛋白质的圆二色性
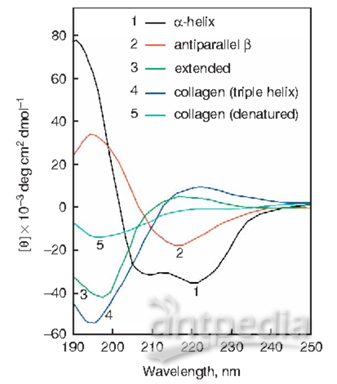
蛋白质是由氨基酸通过肽键连接而成的具有特定结构的生物大分子。蛋白质一般有一级结构、二级结构、超二级结构、结构域、三级结构和四级结构几个结构层次[4-6] 。在蛋白质或多肽中,主要的光活性基团是肽链骨架中的肽键、芳香氨基酸残基及二硫桥键。当平面圆偏振光通过这些光活性的生色基团时,光活性中心对平面圆偏振光中的左、右圆偏振光的吸收不相同,产生的吸收差值,由于这种吸收差的存在,造成了偏振光矢量的振幅差,圆偏振光变成了椭圆偏振光,这就是蛋白质的圆二色性。圆二色性的大小常用摩尔消光系数差△e (M-1 ·cm-1 )来度量。蛋白质的CD光谱一般分为两个波长范围,即178—250 nm为远紫外区CD光谱,250—320 nm为近紫外区CD光谱, 具有不同二级结构的蛋白质或多肽所产生CD谱带的位置、吸收的强弱都不相同。近紫外CD光谱的测量与远紫外CD测量相似,但近紫外CD光谱测量所需蛋白质溶液的浓度一般比远紫外CD测量高1~2个数量级,其测量可在1 cm的方形石英池中进行。
由于CD是一种定量的、灵敏的光谱技术。所以,样品的准备及测量条件的选择对分析计算蛋白质构象的准确性至关重要,一般测试用的蛋白质样品中应避免含有光吸收的杂质,缓冲剂和溶剂在配制溶液前最好做单独的检查,透明性极好的磷酸盐可用作为缓冲体系。CD光谱的测量一般在蛋白质含量相对低(0.0l-0.2 g/L)的稀溶液中进行,溶液最大的吸收不超过2。稀溶液可减少蛋白质分子间的聚集。但如果太稀,则导致蛋白质过多地吸附在容器壁上,影响实验的准确性。
-
仪器推荐

-
仪器推荐
-
仪器推荐
 询底价 Tel:400-6699-117 转 7875
询底价 Tel:400-6699-117 转 7875 -
仪器推荐
-
仪器推荐

-
焦点事件