全自动在线固相微萃取测定水中氯霉素
本方法采用Waters OA在线固相萃取装置,简化复杂的离线固相萃取操作,降低人工成本,提高分析效率,该方法灵敏度高,可移植性好,可满足氯霉素在水体的痕量快速检测。
抗生素面世以来,人们找到抑制细菌生长的方法,大卫教授于1947年发现可产生氯霉素的链霉菌,1949年氯霉素引入临床使用。近代,氯霉素因价格低廉曾大量应用于畜禽养殖业及水产业,氯霉素的不完全代谢会残留在动物肉制品及水产品中,人类食用含有氯霉素的动物制品时,可能导致造血障碍等毒副作用。
现代人长期暴露在抗生素环境中,人体在食物中积累抗生素,导致细菌产生耐药性,同时也有报道指出抗生素会对人体造成毒理损害和三致风险。在国内,人们对抗生素的消耗巨大,大部分抗生素不能被人体完全吸收。抗生素及其代谢产物可通过排泄的方式进入到生活污水,在污水处理中抗生素可能会影响到地下水和环境地表水,对水生生物和土壤有潜在风险。有文献指出在1992年,氯霉素类和头孢类内酰胺类抗生素年用量为18 t,占总抗生素用用量的52.9%。Sacher等人分析了德国巴登维尔茨堡105个地下水井,抗生素检出率较高。有人分析了珠江广州河段中氯霉素的一年中含量在 11-266 ng/L。
目前,抗生素的环境生态学研究较少,在土壤的残留时间与其代谢有关,可能在雨水冲刷土壤的情况下对地下水造成污染。废水和水环境中的药物污染已经引起了人们的注意。随着抗生素广泛使用,环境中检测到的抗生素种类繁多,其环境残留浓度也逐年升高。另外,由于抗生素对生态平衡的影响和人体健康潜在威胁的暴露,抗生素的环境行为倍受人们关注。人类过量摄取抗生素风险的主要途径是食物和受抗生素污染的饮用水。抗生素在环境水体中的含量极低,需对目标化合物富集才能对其进行定量检测。
目前,抗生素检测方法有高效液相色谱法、液相色谱质谱联用法、荷移分光光度法等。其中液质联用法因其分离效果好,灵敏度高,在实际应用中使用最多。传统液质连用法前处理使用手工固相萃取进行富集,然后用液质联用进行检测。手工固相萃取富集方法繁琐,耗费大量时间和人力物力,不适用于大批量做样品和应急检测等特点。本文采用的是沃特世公司的全自动在线前处理-超高效液相色谱串联质谱联用系统,系统使用在线固相微萃取系统,仅需对样品进行简单的过0.22μm滤膜处理,利用在线固相萃取技术,可快速对样品进行富集,节省分析时间。集成化的在线固相处理系统应对抗生素水体污染突发事件,具有快速出具数据,重复性好,方法可移植性强等特点。

图1 全自动在线固相萃取仪的工作原理
实验方法
仪器与设备
超高效液相色谱-三重四级杆质谱系统(Waters Quattro Premier XE)美国;
全自动在线固相萃取前处理仪(2777C Sample Manager)美国;
超纯水系统(Thermo MicroPure UV)德国;
在线固相萃取柱(Waters Oasis HLB Direct Connect HP(2.1 x 30 mm,20μm))美国;
滤膜(安谱PTFE针式滤器(水系)0.22μm)中国。
全自动在线固相萃取仪的工作原理见图1,四元溶剂泵(QSM)和二元溶剂泵(BSM)分别服务于样品萃取富集系统以及液相检测系统。分析过程分为样品萃取富集以及样品检测阶段。在样品萃取富集阶段,从2777C进样器进样5 ml样品,通过四元溶剂泵(QSM)采用2 ml/min水溶液将样品加载在萃取柱1上,待目标化合物全部加载在萃取柱1后,使用B溶剂和C溶剂按一定比例作为淋洗液除杂。清洗除杂后,切换萃取柱A到UPLC系统,通过二元溶剂泵(BSM)采用高有机相比例,将萃取柱1上吸附的目标化合物洗脱到UPLC系统中进行样品检测。在萃取柱1的洗脱过程中,萃取柱2在四元溶剂泵(QSM)中进行再生,恢复萃取柱初始条件等待下一次分析。
主要试剂
标准品:氯霉素(CAP)、购于德国Dr. Ehrenstorfer GmbH,所有标准品纯度≥ 94.0%。
普通试剂:乙腈、甲醇、甲酸、丙酮均为色谱纯。
标准溶液的配制与储存:准确称取10.0 mg标准品于10 mL容量瓶中,由甲醇溶液稀释定容为1.00 mg/mL的标准储备液。标准储备液于-4 ℃下密封、避光保存,使用时应恢复至室温,并摇匀。使用时,取适量标准储备液,用纯水稀释至所需浓度。
在线固相萃取条件
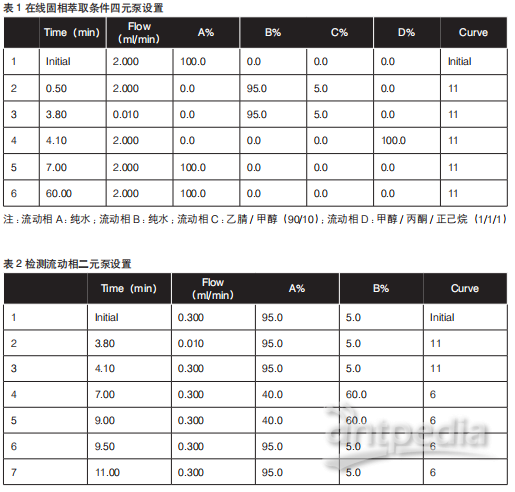
目标分析物的在线萃取条件详见表1及表2。
UPLC-MS/MS 条件
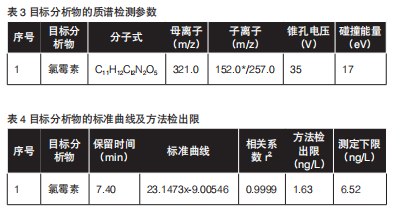
质谱条件:氯霉素用负离子模式(ESI-)的毛细管电压3.0 kV;萃取电压3 V;透镜电压0.1 V;离子源温度120℃;脱溶剂温度450 ℃;辅助气流速1000 L/h;锥孔N2流速50 L/h;碰撞气Ar流速0.15 mL/min。目标分析物的质谱检测参数详见表3。
方法优化
1.样品PH
当样品的PH=7时,目标化合物的信号较强。氯霉素在水溶液PH=4.5-7较稳定,碱性条件下,氯霉素不稳定,易发生水解。在酸性条件下,可发生酰胺水解,选择PH=7作为样品PH。
2.萃取柱
在富集柱选择上,当使用HLB萃取柱时,氯霉素的响应值明显高于C18柱。由于两种目标化合物有羟基,带有一定极性。C18柱为反向萃取柱,对极性化合物保留较差。HLB柱也为反向萃取柱但因其载体中带有特殊亲水基团对极性化物也有较好的富集效果,吸附效果较传统硅胶基质SPE(如C18)好,选择HLB柱作为萃取柱。
3.流动相
当流动相为乙腈-0.1%甲酸水时,氯霉素信号大幅下降。当流动相为乙腈-水时,氯霉素的信号增强。酸性条件下不利于氯霉素负离子电离,氯霉素液相流动相条件选择乙腈-纯水。
4.上样溶液
本在线固相萃取系统把四元泵中A相溶液作为上样溶液,通过四元泵把样品富集到HLB小柱。上样溶液对富集效果影响较大。当使用0.05%甲酸溶液作为上样溶液时,目标物响应值下降,选取100%纯水作为上样溶液。
方法验证
标准曲线绘制
用纯水将混合标准溶液稀释成浓度为10、20、40、80、160、320 ng/L的系列工作溶液,在最佳试验条件下进行测定,以各化合物峰面积Y对质量浓度X进行线性回归,两种抗生素的回归方程、相关系数和方法检出限见表4。
从表中可以看出,氯霉素10-320 ng/L浓度范围内峰面积与质量浓度呈现良好的线性关系。目标抗生素的方法检出限为氯霉素:1.63 ng/L,测定下限为氯霉素:
6.52 ng/L,可满足水环境中抗生素痕量分析的要求。
方法准确度与精密度
取空白水样(纯水),加入一定量的标准溶液,获得10 ng/L的加标样品,全过程分析,平行测定11份,做精密度测试,相对标准偏差见表5。
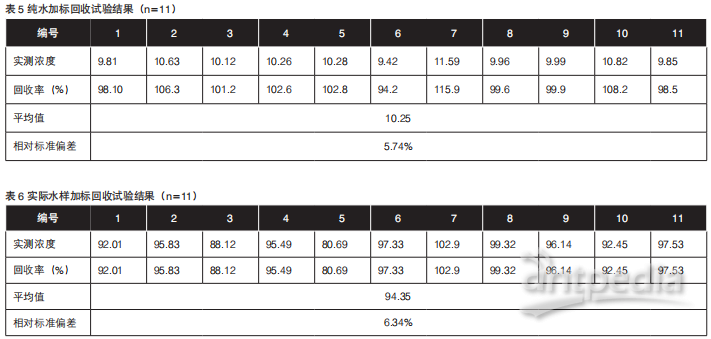
取实际水样,加入一定量的标准溶液,获得100 ng/L的加标样品,全过程分析,平行测定11份,做加标回收测试,各组分回收率表6。
从表中可以看出,空白水样平均加标回收率为94.2%-115.9 %,地表水水样平均加标回收率为88.12%-102.90%,方法的准确度良好。空白加标水样测试的相对标准偏差为5.74%,地表水加标水样测试的相对标准偏差为6.34%,方法的精密度良好,满足水中检测要求。
结论
相对于传统固相萃取技术,在线固相微萃取技术前处理简单,仅需将20 ml水样过0.22μm滤膜,每个样品检测时间为11分钟,能节省大量前处理时间和人力成本。传统固相萃取技术因上样时间,洗脱速度等条件不易控制,实验误差与人操作关系较大。在线固相微萃取技术能减少人为误差,提高实验重复性。本文方法使用MRM模式进行定量,CAP的方法检出限为1.63 ng/L,线性范围为10-320 ng/L,相关系数R=0.9999,实际水样回收率为80.69%-102.90%,相对标准偏差为6.34%,满足水中痕量分析的要求。






















