丝氨酸蛋白酶活性的调节方法
宿主生物必须确保丝氨酸蛋白酶的活性得到充分调节。这是通过对初始蛋白酶激活和抑制剂分泌的要求来实现的。
酶原激活
酶原是酶的通常无活性的前体。如果消化酶在合成时活跃,它们会立即开始咀嚼合成器官和组织。急性胰腺炎就是这样一种情况,其中胰腺中的消化酶过早激活,导致自我消化(自溶)。它还使死后调查复杂化,因为胰腺通常会在进行肉眼评估之前自行消化。
酶原是大的、无活性的结构,能够分解或变成较小的活化酶。酶原和活化酶之间的区别在于,酶原催化的活性位点是扭曲的。结果,底物多肽不能有效结合,不发生蛋白水解。只有在激活后,酶原的构象和结构发生变化,活性位点被打开,才能发生蛋白水解。
抑制
某些抑制剂类似于四面体中间体,因此会填满活性位点,阻止酶正常工作。胰蛋白酶是一种强大的消化酶,在胰腺中产生。抑制剂阻止胰腺自身的自我消化。
丝氨酸蛋白酶与丝氨酸蛋白酶抑制剂配对使用,当不再需要它们时会关闭它们的活性。
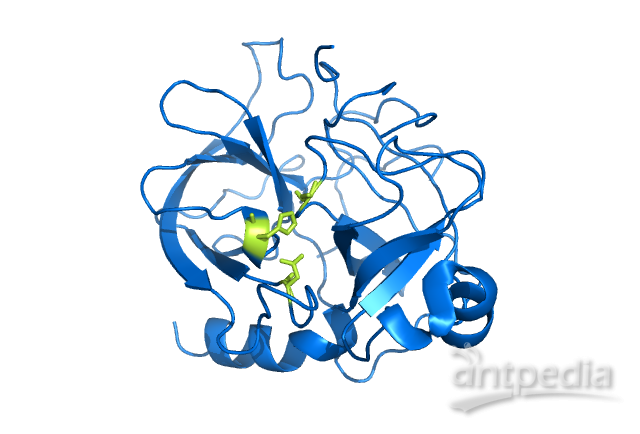
丝氨酸蛋白酶被多种抑制剂抑制,包括用于研究或治疗目的的合成化学抑制剂,以及天然蛋白质抑制剂。一类称为“丝氨酸蛋白酶抑制剂”(缩写为丝氨酸蛋白酶抑制剂)的天然抑制剂可以与丝氨酸蛋白酶形成共价键,从而抑制其功能。研究最多的丝氨酸蛋白酶抑制剂是抗凝血酶和α1-抗胰蛋白酶,分别研究了它们在凝血/血栓形成和肺气肿/A1AT中的作用。人工不可逆小分子抑制剂包括AEBSF和PMSF。
已经在蝗虫和小龙虾中发现了一个名为pacifastin的节肢动物丝氨酸肽酶抑制剂家族,并且可能在节肢动物的免疫系统中起作用。