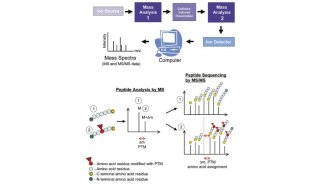
Cell:不同生物的N-糖基化修饰途径
蛋白质翻译后修饰是指蛋白质在翻译后的化学修饰,它包含磷酸化、乙酰化、泛素化和甲基化等类型, 在调节蛋白质活性、结构和功能等方面发挥着重要的作用, 其重要性已被人们广泛认知。
随着许多新的翻译后修饰类型的出现, 蛋白质翻译后修饰这一研究领域变得越来越复杂而有趣。其中糖类的翻译后修饰能帮助蛋白定位和完成其功能,最新一期(9月22日)Cell杂志以“N-Glycosylation Processing Pathways across Kingdoms”为题,介绍了不同生物完成这样复杂和高度可变结构的翻译后修饰的核心途径。
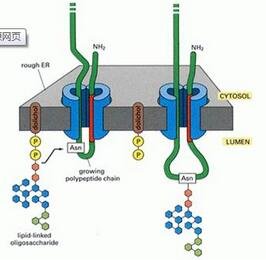
真核细胞中的蛋白质N-糖基化,是在两种不同的细胞器内完成,分别为内质网和高尔基体,首先参与N-聚糖的生物合成。N-聚糖的生物合成,从一种Man5-GlcNAc2蛋白的聚集开始,这种蛋白与ER胞质一侧的多萜醇磷酸酯(dolicholphosphate)连接在一起。这种蛋白翻转到ER腔的一侧,不同的糖基转移酶会逐步地将4个Man和3个Glc残基添加到这个部位。然后,寡糖转移酶复合物将寡糖Glc3Man9GlcNAc2糖基全体转移到分泌性蛋白的特定Asn残基上。一旦糖蛋白发生折叠和寡聚体化,它们就被转移到高尔基复合物中,进行进一步的N连接聚糖修饰。
N-糖基化修与植物免疫
一项研究表明,ALG3介导的效应蛋白Slp1的N-糖基化,对于其在稻瘟病菌中的活性至关重要。ALG3编码一个α-1,3-甘露糖转移酶用于蛋白质N-糖基化。删除ALG3可抑制菌丝的继发感染,并显著降低毒性。研究人员观察到,Δalg3突变体可在宿主细胞内诱导活性氧的大规模生产,其方式与Δslp1突变体类似,这是抑制突变体感染菌丝的一个关键因素。Slp1会隔离几丁质寡糖,来避免被水稻几丁质诱导子结合蛋白CEBiP的识别和先天免疫反应的诱导,包括活性氧生产。
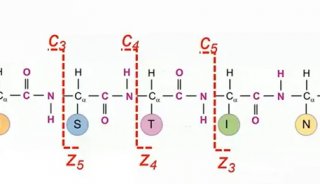
这项研究指出,Slp1有三个N-糖基化位点,同时Alg3介导的每个位点的N-糖基化作用,是保持蛋白质稳定性和Slp1几丁质结合活性所必不可少的,这对于其效应蛋白的功能非常关键。这些结果表明,Alg3介导的Slp1蛋白N-糖基化作用,对于稻瘟病菌逃避宿主的先天免疫至关重要。