体内高效抑制HIV重大进展
在一项新的研究中,来自美国希望之城和澳大利亚格里菲斯大学的研究人员开发出一种新的抗HIV蛋白,可以抑制小鼠骨髓、脾脏和大脑中的HIV水平,并阻止这种病毒在这些部位中的复制。相关研究结果于2021年9月20日发表在Nature Communications期刊上,论文标题为“Exosome-mediated stable epigenetic repression of HIV-1”。
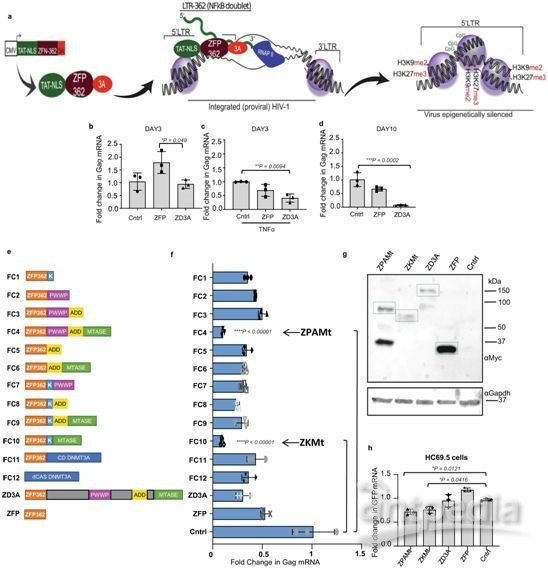
他们开发了一种靶向HIV-1启动子的锌指蛋白(ZFP-362),它与DNA甲基转移酶3 A(DNMT3A)的活性结构域融合在一起而产生融合蛋白ZFP 362b-DNMT3A(ZD3A),以诱导HIV-1长期稳定的表观遗传抑制。细胞经改造后产生用编码这种HIV-1抑制蛋白的RNA包装的外泌体。他们发现,加载这种RNA的抗HIV-1外泌体抑制了病毒表达,而且这种抑制在人源化NSG小鼠模型中是由HIV-1的DNA甲基化驱动的。这些研究结果为开发外泌体介导的治疗性货物以便在表观遗传上抑制HIV-1感染的系统性递送平台铺平了道路。
他们的研究表明,科学家们可以对外泌体进行改造,使之将治疗性分子货物运送到难以到达的地方,包括几乎无法穿透的血脑屏障。这种创新的递送系统为未来铺平了道路:可以想象,经过改造的外泌体可以携带抑制传染病或重组遗传物质的分子货物,使病原体变得无害。
论文通讯作者、希望之城基因治疗中心的Kevin Morris教授说,“这种创新技术可能成为一种可行的方法,不仅为HIV而且还为其他疾病(包括影响大脑的疾病,如阿尔茨海默病和帕金森病)递送药物。”
HIV攻击帮助身体抵抗感染的细胞,使人体更容易受到其他感染和疾病的影响。许多科学家们认为,治愈HIV的一个方法是“阻断并锁定(block and lock)”:阻碍这种病毒的复制能力并将它锁定在休眠状态。
从ZFP362和抑制结构域的融合中筛选强效的HIV-1抑制物。图片来自Nature Communications, 2021, doi:10.1038/s41467-021-25839-2。
Morris说,“我们开发的ZFP 362b-DNMT3A被包装到外泌体纳米颗粒中,并能进入细胞,在那里它能在表观遗传学上使HIV沉默。我们发现,这些纳米颗粒可以系统性地‘阻断和锁定’HIV的表达。这是第一次成功地在体内将阻断和锁定用于治疗大脑中的HIV感染。”
HIV可以在类似休眠的状态下进入人体;它能够躲避人体的免疫系统并逃避治疗。它可以在以后重新激活。隐藏在大脑中的HIV尤其难以治疗,因为血脑屏障阻止有毒物和药物进入大脑。
目前,没有治愈HIV感染的方法,所以一旦有人感染,他或她将终生患病。根据美国疾病控制预防中心(CDC)的数据,截至2019年底,美国估计有119万人感染HIV。在澳大利亚,根据澳洲艾滋病组织联盟的数据,2019年有29045名HIV感染者。
参考资料:
Surya Shrivastava et al. Exosome-mediated stable epigenetic repression of HIV-1. Nature Communications, 2021, doi:10.1038/s41467-021-25839-2.
-
科技前沿