探究多重响应分子荧光探针与细菌感染之间的关系
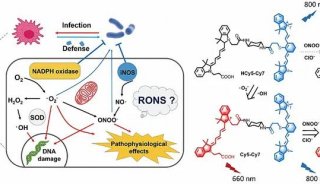
当前,新型病原体的不断进化以及抗生素耐药性的广泛传播,使得细菌感染仍然是威胁人类健康的主要疾病之一。研究人员已发现炎症反应,免疫激活等因素都参与了感染的发病。在感染相关的各种生物因子中,细菌诱导巨噬细胞产生的活性氧(ROS)和活性氮(RNS)自由基在感染介导的炎症级联反应,及其引发的内在杀菌效应方面起到重要作用。其中,ROS(O2•-, •OH, H2O2)主要来源于细胞内NADPH氧化酶及线粒体呼吸链,而RNS(NO, ONOO−)则源于一氧化氮合酶(NOS)激活。
早期研究细菌感染刺激生物体产生活性自由基的异常变化,主要依靠常规的组织学或生化测试等终点分析方法(EPA),但这些策略在实时监测感染状态和病理演变之间的关系上存在局限。因此,非常需要简单、安全并且有效的方法能够为精准的感染诊断和治疗干预提供依据。
值得注意的是,近年来光学影像技术用于检测活性自由基表现出很好的灵敏度和特异性,并在理解细菌感染伴随的氧化应激机制方面取得了不错的进展。但是,关于感染病理机制,宿主免疫激活和多自由基(RONS)之间的实质相关性的问题,目前还缺乏有效的手段去揭示。

针对这一问题,新加坡南洋理工大学邢本刚教授课题组近日取得了重要进展。通过巧妙地组合不同类型自由基敏感的近红外荧光分子,该课题组设计并合成了一种双波长多重信号反向响应的花菁二联体分子探针(HCy5-Cy7),用于在体外和活体小鼠中实时监测细菌感染过程中ROS和RNS的变化。细菌感染过程中,炎症相关的ROS(O2•-或•OH)过量产生,从而将HCy5-Cy7的还原型花菁部分(HCy5)氧化成共轭的Cy5,特异性地在660 nm处发出荧光。而RNS(如ONOO-)的产生会降解Cy7结构,从而导致800 nm处的荧光消失。这种独特的多光谱通道信号响应使得HCy5-Cy7能够同时研究RONS,并且可以将氧化/硝化应激的变化与体外及体内细菌感染的致病机制相关联。
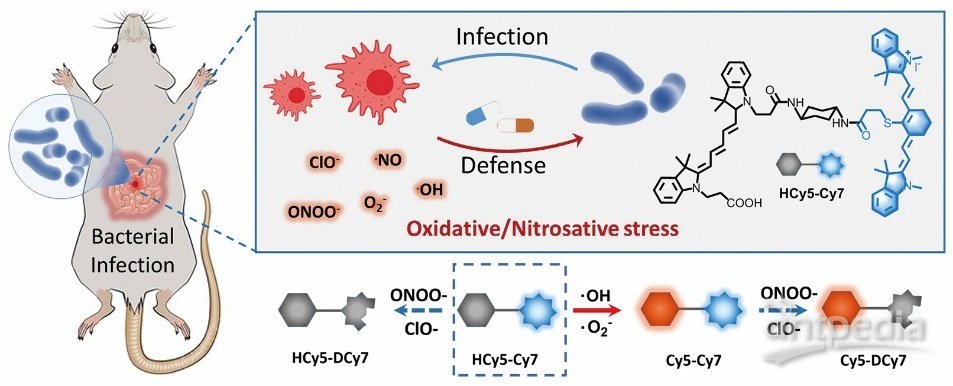
实验结果表明,该花菁二联体荧光分子探针HCy5-Cy7在溶液中对ROS和RNS表现出优越的区分能力,同时在不同波长下的信号变化呈相反的趋势,进一步增加了检测的准确性。另外,HCy5-Cy7能够有效地对细胞内源性多自由基的产生进行共聚焦成像分析。在进一步的体外及体内细菌感染模型中,此多重响应探针分子验证了不同革兰氏阳性、阴性细菌感染状态下的RONS演化动态差异,以及不同感染阶段的多自由基变化趋势。
总体而言,这项研究为理解氧化/硝化应激与细菌感染发病机理,以及宿主防御应答之间的内在联系提供了新的视角,将有助于当前以影像学为指导的精准医学在对抗感染疾病方面的诊断及应用。