布鲁克 MALDI HiPLEX-IHC 真正的空间多组学表征解决方案

免疫组化(IHC)是用于表征细胞间蛋白、各种组织表面细胞的技术手段。在肿瘤病理研究中,常常通过免疫组化分析来确定疾病的标志物,它不仅可以用于指导合适的治疗方法设计,还可以帮助找出不同病理亚型的生物学特征,以作为预后或预测性的评估。在很多实际的分析实验中,常常需要同时获取一系列生物标志物的空间位置信息,以及它们潜在的、可能出现的共定位分布,这就对方法的检测通道数量有较高的要求。免疫组化技术在检测通量方面具有一定的局限性。以免疫荧光为例,分子发色团通常具有较宽的激发谱带和发射谱带,会导致光谱的重叠。由于上述原因,免疫荧光的平行检测通道上限常常是3-5个,通过多光谱组合的方法最多也只能实现8个平行检测通道[1]。
为了解决上述的局限性、并进一步拓展免疫组化技术所能提供信息的维度,布鲁克和AmberGen公司合作,将其深耕多年的MALDI质谱成像技术与经典的IHC相结合,于今年6月份推出了MALDI HiPLEX-IHC多重抗原检测结合质谱成像的一站式解决方案。MALDI质谱成像是一种免标记的分析技术,它可以实现多种生物分子(如药物小分子、代谢小分子、脂质、糖类、核酸、蛋白质等)的空间位置表征。它的分子辨别能力(或多通道平行检测能力)来自于质量数差异,以常规的质谱仪为例,通常质量数差异>1.0Da,即可对具有特定分子量的目标分子实现特异性检测,因此在单次实验中,常常可达几百到上千个分子通道。利用上述特性,只需要在抗体上连接设计好的肽质量标签(PC-MT),经过抗体跟抗原的特异性反应,肽质量标签就会“聚集”在目标抗原位置,再通过MALDI质谱成像技术检测肽质量标签特征片段,就可以以高通量的检测方式、给出多种目标抗原的空间分布信息。

图1:PC-MT肽质量标签的化学结构以及后续的抗体-抗原特异性反应的原理示意图[1]。
图1不仅展示了PC-MT肽质量标签的化学结构,也给出了MALDI HiPLEX-IHC的工作流程:首先,形成“肽质量标签-抗体”复合物。其次,使复合物中的抗体与组织切片中的目标抗原发生特异性结合。第三步,发生光解反应,使“报告离子”释放出来。最后,喷涂基质,随后进行MALDI质谱成像数据采集,通过检测“报告离子”位置、进而描绘出目标抗原在组织中的空间分布。
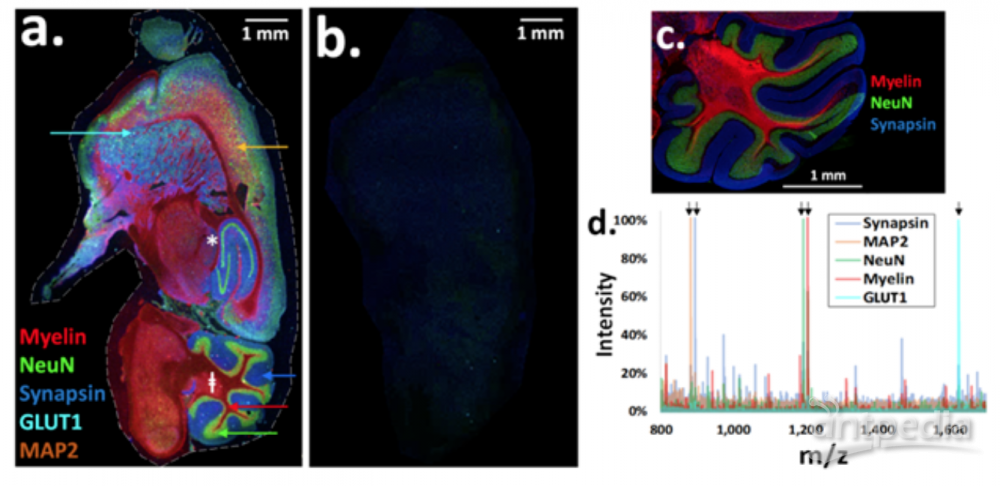
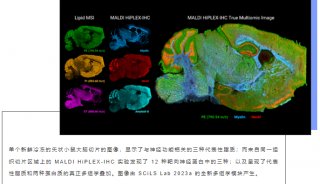
图2:五通道MALDI HiPLEX-IHC用于小鼠鼠脑FFPE类型矢状切片的空间蛋白组学表征[1]。
图2a展示了利用MALDI HiPLEX-IHC技术,对小鼠鼠脑FFPE类型矢状切片、同时进行五分子通道空间蛋白组学表征。图中的五种颜色分别代表了Myelin(髓鞘质,神经纤维轴突鞘的标志物)、NeuN(神经元细胞核的标志物)、Synapsin(突触蛋白) 、GLUT1(一种在脑组织毛细血管中含量很高的蛋白)、MAP2(一种在神经组织中、与微管相关的蛋白)。在一张图中,五种蛋白的同时呈现、有效地描绘出了鼠脑的特征性多层次剖面结构。图2b为连续切片,但在实验流程中将抗体替换为兔的IgG抗体,保持肽质量标签不变。由于抗体被替换,无法与鼠脑切片的抗原发生特异性结合,因此无法检测到任何质量信号;该实验也说明鼠脑切片中不会出现任何与报告离子质量接近的内源性背景分子干扰。图2c为Myelin、NeuN和Synapsin的免疫荧光图像的叠加谱图,该图与图2a完全一致,充分验证了MALDI HiPLEX-IHC实验的专一性及其结果的可靠性。
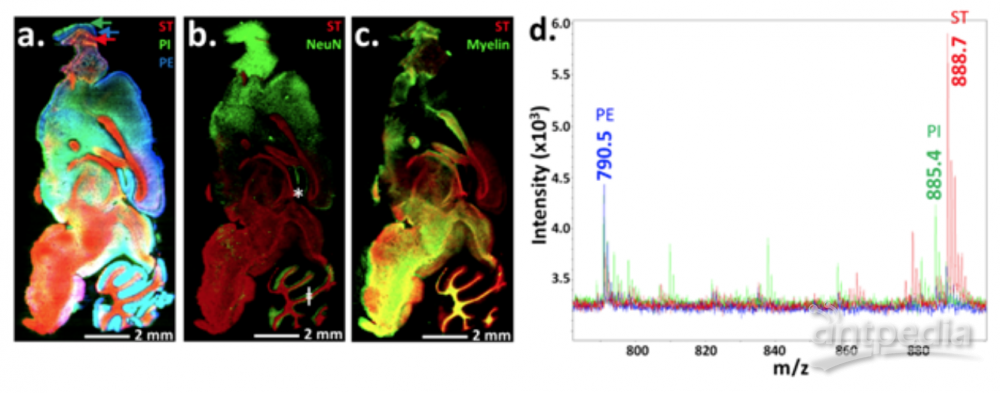
图3:通过MALDI HiPLEX-IHC技术,在同一块组织切片上、同时实现了非靶向的小分子成像及靶向大蛋白成像[1]。
图3展示了利用MALDI HiPLEX-IHC技术,在新鲜的小鼠鼠脑矢状切片上实现了真正的空间多组学表征。首先,以1,5-DAN为基质、在负离子模式下对鼠脑切片进行第一轮MALDI成像数据采集(针对小分子的非靶向成像实验)。然后,用低温丙酮洗去1,5-DAN基质,执行如图1展示的MALDI HiPLEX-IHC的工作流程,并进行第二轮MALDI成像数据采集(针对目标蛋白的靶向成像实验)。对第一轮MALDI成像的实验结果做分析,经过与METLIN数据库比对并结合已报道的实验数据,得到图3a和图3d中的三个脂质分子:红色为ST (24:1),m/z 888.7;绿色为PI (38:4),m/z 885.4;蓝色为PE (40:6),m/z 790.5。其中ST与另外两个脂质的空间分布有很大的差异,而PI与PE的空间分布具有一定的相似性,即呈现出一定的“空间共定位”效果。图3b同时展现了ST脂质与NeuN蛋白的空间分布,两者的分布截然不同,几乎没有重叠的部分。图3c同时展现了ST脂质与Myelin蛋白的空间分布,ST的红色与Myelin的绿色在图片的下方表现出很多交叠——形成了大片黄色区域,证明两者具有很强的“空间共定位”效果。图3b与图3c 所展现的实验结果与文献报道具有高度的一致性:ST脂质通常不会出现在神经元细胞核的周围,而它常常在神经纤维的轴突鞘中具有很高的含量。图3的实验结果与之前图2的具有高度的一致性,说明图3所采用的“同一个组织切片、一先一后的两轮成像方式”并没有引起大蛋白的位置迁移,是行之有效的空间多组学表征方案。

图4:MALDI HiPLEX-IHC实验流程;其适用于布鲁克的rapifleX和timsTOF fleX质谱仪。
布鲁克所推出的MALDI HiPLEX-IHC空间多组学表征方案,将蛋白分子的空间表征提升到新的水平,即在同一块组织切片中、同时实现了代谢小分子成像和与转录组相关的靶向蛋白成像。该技术不仅可以绘制蛋白质表达图谱,还可以研究相关的代谢活动。在新药开发领域,布鲁克MALDI HiPLEX-IHC可以用于研究小分子药物与药物作用靶点(例如受体、酶等)等的共定位分析;通过空间分布分析,还能找出与参与到细胞对药物响应过程的生物分子。
该方案适用于布鲁克的rapifleX和timsTOF fleX质谱仪。两款成像质谱仪均具有优异的MALDI成像性能,布鲁克MALDI HiPLEX-IHC空间多组学表征方案的引入,将从数据采集速度、信号分辨能力和分子分析深度三个维度,实现空间组学表征能力的全方位提升,推动空间组学技术的长足发展。
参考文献:
[1] Highly Multiplexed Immunohistochemical MALDI-MS Imaging of Biomarkers in Tissues, J. Am. Soc. Mass Spectrom. 2021, 32, 977−988.