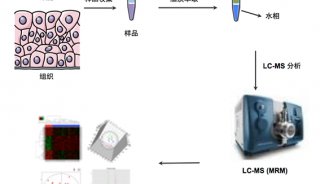
病毒入侵与细胞脂质代谢: 脂质分布影响膜曲率、病毒的萌芽及其在宿主细胞内的复制
越来越多研究表明,相关的脂质代谢通路与病毒的萌芽、入侵宿主细胞、及其复制的过程密切相关[1-7]。我们前期的一系列合作工作都证明了脂质参与了病毒的萌芽及其在宿主细胞内的复制过程:(1)通过对人类免疫缺陷病毒1型(HIV-1)和小鼠白血病病毒(MLV)的脂质组学分析研究发现,HIV-1和其它逆转录病毒从富含胆固醇的质膜区域萌芽,并利用基质/磷脂酰肌醇4,5-二磷酸的相互作用从细胞中释放出颗粒[1];(2)丙型肝炎病毒(HCV)感染是与脂肪变性相关的危险因素之一,可诱导肝细胞内脂滴(LD)的积累,细胞质磷脂酶A2γ(PLA2G4C)是HCV感染上调并参与HCV复制的宿主因子[2];(3)宿主细胞中的胆固醇、脂肪酸水平会影响病毒感染,如登革热病毒依赖宿主胆固醇和脂肪酸生物合成来成功复制,胆固醇转运抑制剂U18666A和脂肪酸合成酶抑制剂C75均具有明显的抗病毒作用[3];(4)宿主细胞可通过免疫因子对相关脂质代谢通路调节进行防御病毒感染, 如1型干扰素可降低宿主感染后的甾醇代谢网络活性[4];(5)此外,病毒包膜的生物物理性质(膜曲率和流动性)对病毒-细胞膜融合至关重要,亲脂性噻唑烷衍生物LJ001可通过对该性质的负调控,抑制许多包膜病毒进入宿主细胞[5]。
2019年4月,霍华德·休斯医学研究所和密苏里大学克里斯托弗·邦德生命科学中心的研究人员在《Nature Cell Biology 》上发表了题为“一种以脂质为基础的划分机制可用于HIV病毒颗粒包膜蛋白的选择性结合”的研究论文,进一步阐明了病毒获得其独特膜蛋白的过程与脂质、膜曲率的关系[8]。

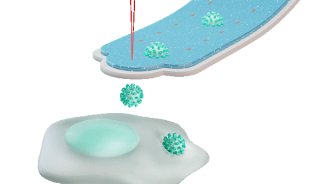
从细胞表面萌芽出来的颗粒,包括病毒和微囊泡,通常具有独特的、不同于原始质膜的膜蛋白组成。这种选择性蛋白质组成使病毒能够逃避免疫反应并感染其他细胞。但是,膜蛋白是如何排序成为萌芽病毒,如人类免疫缺陷病毒(HIV),目前还不清楚。蛋白质可以被动地分布到HIV装配部位的膜中,产生类似于现有质膜结构域的成分。研究人员证明了蛋白质反而会积极地排序进入HIV装配位点膜中,产生富含胆固醇和鞘脂质的复合物,这些复合物会不断地进行重构。由HIV结构蛋白Gag的寡聚作用启动,并通过基于脂质的分选,蛋白质被招募到HIV组装位点或从该位点移除。组装位点膜曲率的变化进一步放大了这种分选过程。因此,一种基于脂质的分选机制,通过增加膜曲率,产生了HIV表面独特的膜成分。
在病毒出芽期间,逆转录病毒,如人类免疫缺陷病毒(HIV),将自己包裹在来自宿主细胞膜(PM)的外脂质包膜中。病毒包膜仅包含宿主PM蛋白的一个子集,包括许多GPI锚定蛋白(GPI-APS)。因此,与块状PM相比,包膜具有独特的蛋白质组成。HIV独特的包膜蛋白组成对病毒的生存和感染至关重要,包膜分离的宿主蛋白如CD59可保护病毒免受先天免疫系统的攻击。然而,尽管经过几十年的研究,HIV包膜优选蛋白质组成的机制仍然不清楚。
有人认为,艾滋病毒包膜的生成是通过一个被动过程发生的,反映了病毒组装位点上已经存在的PM蛋白组成。分布在这个部位的分子会被动地融入病毒包膜,而那些域外的分子则被排除在外。然而,另一种可能性是,一个活跃的过程驱动蛋白质整合到病毒包膜中。在这种观点下,某些类型的脂质和膜蛋白被吸引到正在组装的病毒包膜中,而另一些则被挤出。本文中研究人员通过实时表征HIV病毒颗粒(VLPs)膜组装位点的脂质和蛋白质的分选来区分这些可能性。通过量化不同蛋白质在这些部位的招募/排除的时间过程,研究人员证明,与周围的PM不同,HIV的膜装配部位通过一个由病毒结构蛋白Gag的寡聚引起的,涉及胆固醇和鞘脂局部排序的过程。膜蛋白根据其对胆固醇/鞘脂富集区的偏好,主动地进入或离开这些装配位点。VLP出芽过程中膜曲率的变化进一步促进了这种以脂质为基础的蛋白质分选进入HIV装配位点的机制。
HIV组装位点构成一个分阶段有序的脂质结构域,以脂质为基础的分选介导了蛋白质在组装位点的再分配
图1. 脂质和脂锚定蛋白在VLP组装位点的富集或缺失与它们在L o和L d脂相之间的分配有关

图2. VLP组装位点膜蛋白的富集或缺失与它们在L o和L d脂相之间的分配有关

装配位点通过蛋白质的连续再分选而成熟
图3. 在VLP装配的不同阶段,不同的PM蛋白在块状PM和VLP装配位点之间重新分布

Tetherin的双膜锚栓介导其后期招募到组装地点
图4. Tetherin双膜锚栓介导了tetherin向VLP装配位点的后期招募

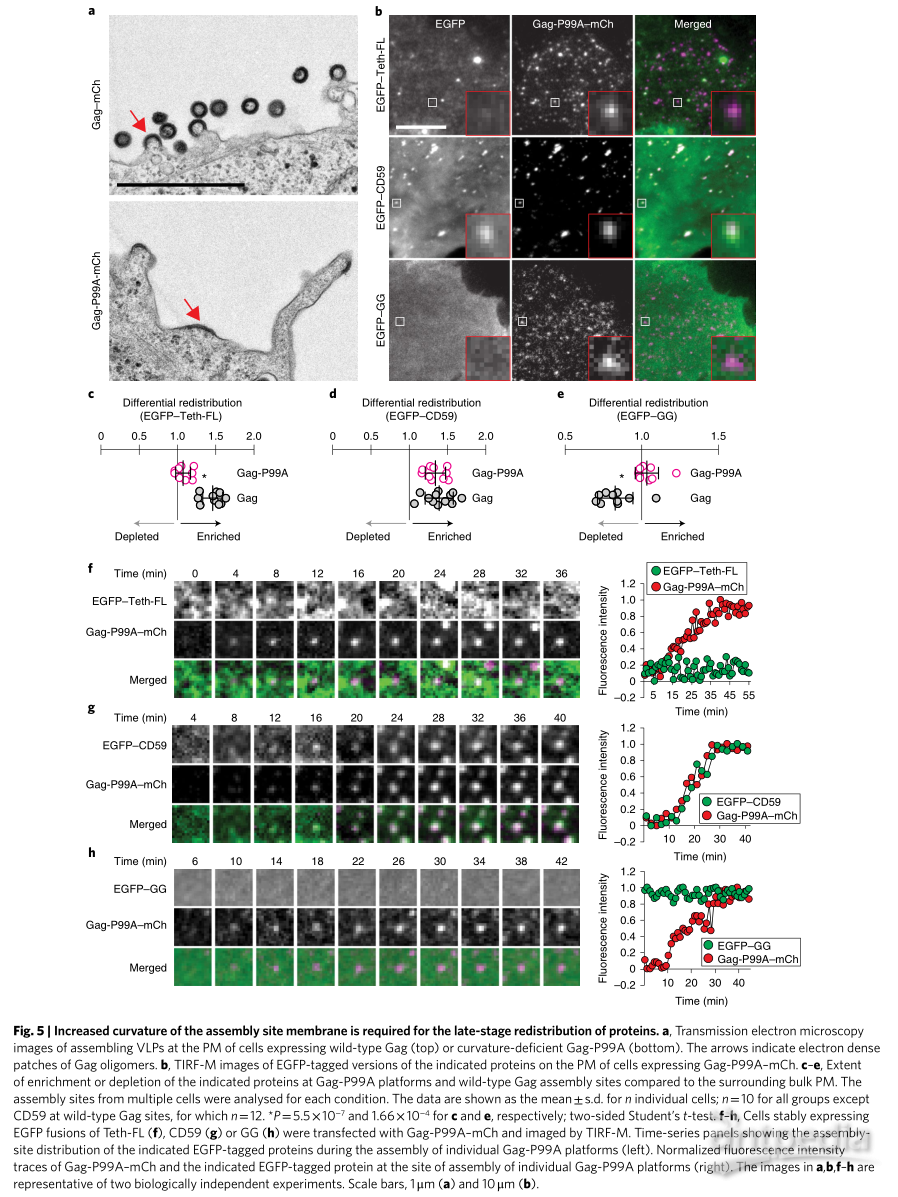
膜曲率的增加促进蛋白质在组装后期的重新分布
图5. 装配位点膜曲率的增加是蛋白质后期再分布所必需的
组装位点蛋白的再分配不需要ESCRT活性
图6. VLP组装位点的蛋白再分布不依赖于ESCRt机制

![]()
本文的发现有助于阐明逆转录病毒如何获得其独特的膜蛋白组成,揭示了HIV病毒主动重组病毒装配位点膜,以产生其独特的蛋白质组成。重构跨越病毒包膜组装的整个过程,并通过一种基于脂质的分类机制发生,这种机制由艾滋病毒组装位点膜曲率的变化辅助。
参考文献
[1]. Chan R, Uchil PD, Jin J, Shui G, Ott DE, Mothes W, Wenk MR.(2008). Retroviruses human immunodeficiency virus and murine leukemia virus are enriched in phosphoinositides. Journal of virology. 82(22):11228-38.
[2]. Su X, Liu S, Zhang X, Lam SM, Hu X, Zhou Y, Chen J, Wang Y, Wu C, Shui G, Lu M, Pei R, Chen X. (2017).Requirement of cytosolic phospholipase A2 gamma in lipid droplet formation. Molecular and cell biology of lipids. 1862(7):692-705.
[3]. Poh MK, Shui G, Xie X, Shi PY, Wenk MR, Gu F.(2012). U18666A, an intra-cellular cholesterol transport inhibitor, inhibits dengue virus entry and replication. Antiviral research. 93(1):191-8.
[4]. Blanc M, Hsieh WY, Robertson KA, Watterson S, Shui G, Lacaze P, Khondoker M, Dickinson P, Sing G, Rodríguez-Martín S, Phelan P, Forster T, Strobl B, Müller M, Riemersma R, Osborne T, Wenk MR, Angulo A, Ghazal P.(2011). Host defense against viral infection involves interferon mediated down-regulation of sterol biosynthesis. PLoS biology. 9(3): e1000598.
[5]. Vigant F, Lee J, Hollmann A, Tanner LB, Akyol Ataman Z, Yun T, Shui G, Aguilar HC, Zhang D, Meriwether D, Roman-Sosa G, Robinson LR, Juelich TL, Buczkowski H, Chou S, Castanho MA, Wolf MC, Smith JK, Banyard A, Kielian M, Reddy S, Wenk MR, Selke M, Santos NC, Freiberg AN, Jung ME, Lee B.(2013). A mechanistic paradigm for broad-spectrum antivirals that target virus-cell fusion. PLoS pathogens. 9(4): e1003297.
[6]. Heinz LX, Baumann CL, Köberlin MS, Snijder B, Gawish R, Shui G, Sharif O, Aspalter IM, Müller AC, Kandasamy RK, Breitwieser FP, Pichlmair A, Bruckner M, Rebsamen M, Blüml S, Karonitsch T, Fauster A, Colinge J, Bennett KL, Knapp S, Wenk MR, Superti-Furga G.(2015). The lipid-modifying enzyme SMPDL3B negatively regulates innate immunity. Cell reports, 11(12):1919-28.
[7]. Blanc M, Hsieh WY, Robertson KA, Kropp KA, Forster T, Shui G, Lacaze P, Watterson S, Griffiths SJ, Spann NJ, Meljon A, Talbot S, Krishnan K, Covey DF, Wenk MR, Craigon M, Ruzsics Z, Haas J, Angulo A, Griffiths WJ, Glass CK, Wang Y, Ghazal P. (2013). The transcription factor STAT-1 couples macrophage synthesis of 25-hydroxycholesterol to the interferon antiviral response. Immunity, 38(1):106-18.
[8]. Sengupta P, Seo AY, Pasolli HA, Song YE, Johnson MC, Lippincott-Schwartz J.(2019). A lipid-based partitioning mechanism for selective incorporation of proteins into membranes of HIV particles. Nature cell biology, 21(4):452.