项目文章 | 欧易生物助力血清保护机体免受TBI诱导的造血损伤机制研究
基本信息
论文题目:Mouse serum protects against total body irradiation-induced hematopoietic injury by improving the systemic environment after radiation
发表期刊: Free Radical Biology and Medicine
发表时间:2018.12.17
影响因子:6.020
作者单位:中国医学科学院放射医学研究所樊赛军教授课题组
本文涉及的高通量技术:基因芯片(Agilent Mouse miRNA 芯片)由欧易生物提供服务
研究背景
全身放疗(total body irradiation, TBI)会诱导多种组织和器官的损伤,例如造血系统。TBI对于造血系统的影响可以分为直接影响与间接影响。其直接影响是指TBI对生物活性大分子例如蛋白、核酸产生影响,进而导致功能失常以及代谢紊乱。间接影响是通过发生水辐解产生自由基,进而导致细胞氧化还原环境失衡最终导致活性氧(reactive oxygen species, ROS)的产生以及在细胞中的积累。游离的自由基仅能存活很短的时间,然而之前的研究表明在进行TBI治疗很长时间后,造血干细胞(hematopoietic stem cells, HSCs)和造血祖细胞(hematopoietic progenitor cells, HPCs)的ROS水平仍旧高于对照组。部分研究表明,TBI造成的微环境的损伤不仅会导致HSCs损伤,还会影响辐射后造血干细胞的恢复,但目前很少有研究关注TBI诱导的全身或血液循环环境变化对HSCs损伤的影响。
研究内容
TBI会引起造血功能的损伤以及血清成分的变化,基于此,作者在文中主要围绕改变血清成分是否能减轻这种损伤进行研究。研究者首先发现经受了过量放疗的小鼠在持续注射未经受辐射小鼠的血清后存活率有了显著的提升。随后作者检测了多个同造血功能、损伤相关的指标,发现经过TBI后的小鼠通过注射血清可以缓解TBI对造血系统的负面影响。再之后作者利用基因芯片技术和iTRAQ技术分别从外泌体的microRNA表达和蛋白表达两个角度证明注射血清有利用辐射小鼠血清成分的恢复。 最后通过体内实验和体外实验确定了外泌体在放射保护中发挥重要的作用,暗示非辐射小鼠血清来源外泌体可能是TBI诱导的HSCs损伤的一种有前途的治疗方法,值得进一步探索。
研究思路

研究结果
1.注射血清可提升暴露于致死量辐射的小鼠的存活率
为了评估血清活性成分的放射保护作用,对照组 (7.2 Gy)与实验组 (7.2 Gy+ Serum)小鼠均在实验开始时暴露于致死量辐射下,实验组的小鼠在照射后立即注射了100 μl未照射小鼠的血清,并在之后的14天内隔天注射血清一次。结果发现第25天时对照组小鼠全部死亡,而实验组小鼠有50%都存活了下来,这些结果表明,注射血清的非辐射小鼠辐射对小鼠造血系统有明显的保护作用。

图 1|血清注射可延长受辐射小鼠生存率
2.血清注射可以缓解TBI导致的造血系统损伤
HSCs的特点包括自我更新和分化,而TBI会引起这两种功能的损伤。已有报道称TBI可引起外周血白细胞数减少和髓系倾斜。基于此研究者测量了多组小鼠的外周血细胞的数量,并用流式细胞术测量B细胞、T细胞和髓细胞的百分比。结果发现与未进行TBI的小鼠对比,TBI后的小鼠WBCs数量明显减少,淋巴细胞百分比(LY%)下降,中性粒细胞百分比(NE%)上升,B细胞和T细胞占比减少,骨髓细胞占比增加。而这种变化可以通过注射非辐射小鼠血清得到缓解(见图2)。

图 2|血清注射可以缓解TBI诱导的HSC分化功能紊乱
(#代表相对control显著, *代表相对4Gy显著)
利用表面标记物检测HSCs、HPCs的占比变化也有相似的结果。TBI照射后LSKs(代表HSCs)、HPCs和CD34+ LSKs (代表短期HSCs) 的比例均发生了下降,而CD34- LSKs (代表长期HSCs)的比例均显著上升。而注射非辐射小鼠血清的TBI小鼠的HSC频率损伤被大幅减少(见图3)。
为探讨血清活性成分对TBI诱导的HSC自我更新能力损伤的放射保护作用,作者还行了竞争性骨髓移植实验。小鼠暴露于TBI后,供体来源的CD45.1细胞显著减少,而在未辐射小鼠血清中注射辐射小鼠后,供体外周血嵌合百分比增加。类似的缓解作用也体现在髓系倾斜上。
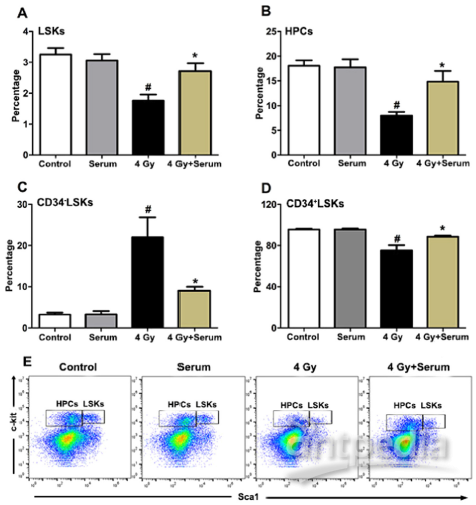
图 3|血清注射可抑制TBI诱导的骨髓造血细胞减少
3.血清注射可以缓解TBI诱导的氧压力以及DNA损伤
目前已知ROS对小鼠暴露于TBI后的HSC损伤有促进作用,但直到目前几乎没有研究报道小鼠血清能清除自由基。为了探讨血清注射是否能保护造血干细胞免受TBI诱导的ROS清除损伤,研究者检测了H2O2来源的ROS、线粒体超氧化物自由基和超氧化物自由基。如图4所示,TBI在辐射的造血干细胞中触发了这些ROS的产生,血清注射降低了这些ROS水平。除此之外,研究者还发现注射血清后DNA损伤情况有了很大的缓解(8-oxoG是DNA损伤标志),SOD2、GPX1和NOX4(前两个是线粒体中两种重要的氧化应激防御酶,NOX4则是一种促氧化酶)的表达水平变化也趋于未进行TBI的情况(见图4)。

图 4|血清注射抑制TBI诱导的HSCs氧化应激和DNA损伤
(A-C) H2O2来源的ROS、线粒体超氧化物自由基和超氧化物自由基的水平变化;(D-E) 注射非辐射小鼠血清对TBI小鼠DNA损伤的影响;(F)氧化应激相应酶的表达水平变化
4.血清注射可以促进TBI小鼠血清成分的恢复
为了探索为何血清的注射可以清除HSCs中的ROS,研究者首先检测了蛋白组的变化情况。如图5所示,许多蛋白在注射血清与否的TBI小鼠中均有表达水平的变化。其中多种免疫反应及炎症相关蛋白的表达水平,例如SAA2免疫球蛋白IGKV6-17,在确血清注射后几乎都降低至正常水平,而细胞因子eEF2和PDGFD在注射血清的小鼠中表达水平升高。考虑到血清成分很复杂,研究者之后选取了外泌体作为材料进行研究。在分离外泌体后,研究者检测了其中microRNA的表达。如图6所示,Hippo通路以及PI3K-Akt通路在TBI小鼠以及注射了血清的TBI小鼠的外泌体中均相对各自的对照组发生了富集。有7种microRNA参与了这两条通路,包括miR-151-5p, miR-1903, miR-195a-5p, miR-23b-3p、miR-290a-5p、miR-470-5p和miR-697。蛋白组和microRNA芯片的结果均显示血清注射可以促进TBI小鼠血清成分的恢复。

图 5|血清注射调节辐射小鼠蛋白的表达

图 6|外泌体差异microRNA靶基因KEGG pathway分析结果
5.外泌体在血清活性成分的辐射保护作用中扮演重要角色
介于Hippo通路和PI3K-Akt信号通路调节氧化应激和ROS生成,为了验证外泌体是否确实发挥着重要的作用。研究者从体内和体外两个层面进行了验证。体外实验作者进行了lineage-c-kit+细胞与外泌体的共培养,发现外泌体的加入显著提升了被辐射细胞的活力,并降低H2O2来源的ROS(见图7 A-B)。作者还分别向TBI小鼠注射了非辐射小鼠血清以及去除了外泌体的非辐射小鼠血清,发现不包含外泌体的血清的治疗效果明显逊于包含外泌体的血清,且外泌体注射可以减轻外TBI诱导的髓系倾斜(见图7 C-I)。

图 7|外泌体在体外和体内均可防止辐射诱导的HSCs和HPCs的损伤
总 结
本研究发现注射非辐射小鼠血清可以减轻TBI诱导的HSCs损伤,这种保护作用涉及到了通过调节氧化应激靶蛋白降低TBI诱导的ROS水平以及血清注射促进血清蛋白和外泌体microRNA的恢复。而进一步对于其中外泌体的研究发现其发挥着一定的辐射保护作用,暗示其可能是一种潜在的治疗TBI诱导的HSCs损伤的方法。
参考文献
Zhang J, Han X, Zhao Y, et al. Mouse serum protects against total body irradiation-induced hematopoietic system injury by improving the systemic environment after radiation. Free Radical Biology and Medicine, 2018. DOI: 10.1016/j.freeradbiomed.2018.12.021
- END -
Sonia Y 撰文
本文系欧易生物原创
欢迎转发到朋友圈
转载请注明本文转自欧易生物
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章







