Protein&Cell | 胆汁酸替代合成途径与代谢性疾病
肠道菌群与葡萄糖代谢、脂代谢密切相关,其中部分菌群通过调节胆汁酸(BA)代谢进而影响多个BA受体信号传导途径。肝脏胆固醇经肝酶代谢,合成初级胆汁酸。合成途径包括经典途径(主要产生12α-羟基胆汁酸,胆酸)和替代途径(主要产生非12α-羟基胆汁酸,鹅去氧胆酸)。BA合成和排泄是胆固醇和脂代谢的主要途径,因此与多种代谢性疾病有关,包括肥胖、糖尿病、非酒精性脂肪肝等。此外,羟化固醇和BAs均可作为信号分子,激活多种组织中的多个核和膜受体介导的信号途径,调节葡萄糖,脂质稳态,炎症和能量消耗。调节BA合成和组成以调节BA信号传导是代谢性疾病治疗的潜在策略。上海交通大学附属第六人民医院和香港浸会大学贾伟教授团队深度总结了BA合成途径(尤其是替代途径)的最新研究进展;探讨BA替代合成途径在治疗代谢性疾病中的前景,相关成果发表于《Protein & Cell》。
BA合成:经典途径和替代途径
BAs主要通过两种途径在肝脏中合成。经典途径或中性途径由CYP7A1酶催化胆固醇发生7α-羟基化作用,随后甾核进一步转化和由CYP8B1催化侧链发生氧化裂解,该途径产生的BA约占75%总胆汁酸。另一个途径是替代途径,也称为酸性途径,由CYP27A1催化胆固醇27-羟基化。该反应经由7α-羟化酶(CYP7B1)进一步催化羟基化。替代途径产生非12-OH BAs,以CDCA为主。这类BAs存在着物种差异,如在啮齿类动物中以鼠胆酸MCA为主,在熊中以熊胆酸UDCA为主,而在猪中以猪胆酸HCA为主。CYP7A1是BA合成的限速酶,CYP8B1消耗或抑制可导致替代途径合成更多BA。
BA合成和代谢失调与啮齿动物和人类的代谢异常有关,例如肥胖、糖尿病和慢性肝病。CYP8B1是CA合成关键酶,它决定了非12-OH BAs(CDCA,α/β-MCA,UDCA,LCA, HCA, HDCA及其他替代途径的衍生物)与12-OH BAs(CA,DCA)的比例。最近研究表明,CYP8B1耗竭或下调引起12-OH BA水平减少,从而增加了非-12-OH / 12-OH BA的比例,对宿主代谢状态产生有益影响。CYP7B1是参与BA替代途径的关键酶。Cyp7b1-/-小鼠棕色脂肪中解偶联蛋白1(UCP-1)表达发生显著下调,表明CYP7B1调控的BAs可能对TGR5(膜G蛋白偶联受体5)激活作用增强。在糖尿病和非酒精性脂肪肝疾病(NAFLD)中,肝脏CYP7B1表达降低,这揭示BA替代途径对于维持代谢稳态的重要作用。研究表明,肥胖的2型糖尿病(T2DM)患者进行Roux-en-Y胃旁路手术(RYGB)前血清CDCA比例呈现高水平,且与T2DM病程相关。基线CDCA水平越高,手术后糖尿病缓解率越高,这提示CDCA在总BA池中的占比可能作为RYGB手术疗效的潜在预后标志物。由此,反映CYP8B1和CYP7B1活性的BA比值可能是决定葡萄糖和脂代谢稳态的关键因素。
替代途径的激活可改善代谢稳态
最近几项研究已经表明,多种外源性物质和内源性BA可以调控BA替代途径,对糖脂代谢具有重要作用(图1)。
茶褐素(TB)是是普洱茶的活性成分,,具有降胆固醇和降脂的作用。小鼠口服TB可抑制肠道细菌胆盐水解酶BSH活性。BSH功能是将结合型BA水解成非结合型BA。富含BSH菌群被抑制后,远端回肠中结合型BAs出现积累。这些结合型Bas以非12OH的牛磺鹅去氧胆酸(TCDCA)和牛磺熊去氧胆酸(TUDCA)为主,可抑制肠道FXR和下游FGF15-FGFR4信号传导,进而上调肝脏中经典和替代途径中BA合成基因CYP7A1,CYP8B1,CYP27A1和CYP7B1的表达。同时,肝脏中CDCA水平激动肝脏FXR及下游SHP信号传导,从而抑制BA合成酶,尤其是CYP8B1。最终,肠道FXR-FGF15和肝FXR-SHP双重调控,最终导致以CYP7B1为主的替代途径合成酶的高表达,肝脏中非12OH和12OH的比值显著升高。采用肠道选择性FXR激动剂fexaramine进一步验证该机制。给予fexaramine后,肠道FXR-FGF15通路激活,而肝脏FXR-SHP通路被抑制,肝脏 CYP7B1表达水平降低,同时TB引起的体重、TC和TG水平降低则被逆转。当小鼠接受肠道特异性FXR拮抗剂Z-Guggulsterone处理时,TB有益作用变得更强。这些结果表明,TB降低胆固醇的作用机制是由于抑制肠道FXR信号从而激活肝脏CYP7B1活性,也为肠道FXR信号与肝BA合成之间联系提供依据。
与TB调节肠道菌群的机制相似,几种有效的BSH抑制剂(如核黄素和咖啡酸苯乙酯(CAPE))有望介导BA替代途径。也有研究报道葡萄籽的提取物成功诱导了小鼠肝脏中CYP7B1表达并降低了肝脏脂质水平。熊去氧胆酸UDCA是首个用于原发性胆源性胆管炎治疗的药物,也已用于治疗非胆汁淤积性、非肝胆疾病和非酒精性脂肪性肝炎。在我们研究中观察到,UDCA添加导致肠道BA浓度升高,主要是TUDCA和甘氨熊去氧胆酸(GUDCA)(FXR拮抗剂)引起肝中CYP7B1表达显著增加。在饮食诱导的NAFLD模型小鼠中,UDCA补充剂可增加CYP7B1 mRNA水平并改善空腹血糖水平和肝脂肪变性。此外,补充UDCA可降低肠道FGF15分泌来刺激BA合成,并伴随血清C4(7α-hydroxy-4-cholesten-3-one)水平升高。
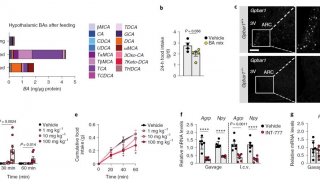
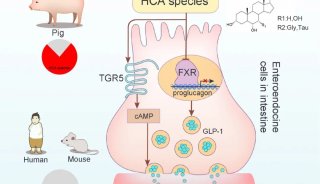
最新的研究证实猪体内高丰度的非12OH BA,猪胆酸HCA及其相关衍生物在肠道中能同时产生抑制FXR和激动TGR5效果,促进肠内分泌细胞生成GLP-1,调节机体的糖脂代谢。大量的临床样本也证实,在糖尿病和脂肪肝患者体内,猪胆酸水平显著下降,与临床血糖、胰岛素、脂质相关的指标有着强相关性。
总的来说,外源性分子,如TB、CAPE、核黄素和葡萄籽提取物等,通过调节肠道菌群降低肠道中的BSH活性发挥作用。这种调节导致回肠末端的结合型BA含量增加,尤其是TCDCA和TUDCA,抑制肠道FXR信号进一步导致CYP7B1(BA合成的替代途径的关键酶)的表达增加,进而导致CDCA增加以及12-OH BAs(CA)向非-12-OH BA转化。已报道,12-OH BAs /非-12-OH BAs比率增加与代谢性疾病有关。TUDCA、UDCA、TCDCA和CDCA处理对CYP7B1表达水平具有相似作用。这些外源性分子或内源性BA有利于增加非12-OH BA的产生从而改善代谢表型。替代途径可以产生有益羟化固醇并解毒有害羟化固醇
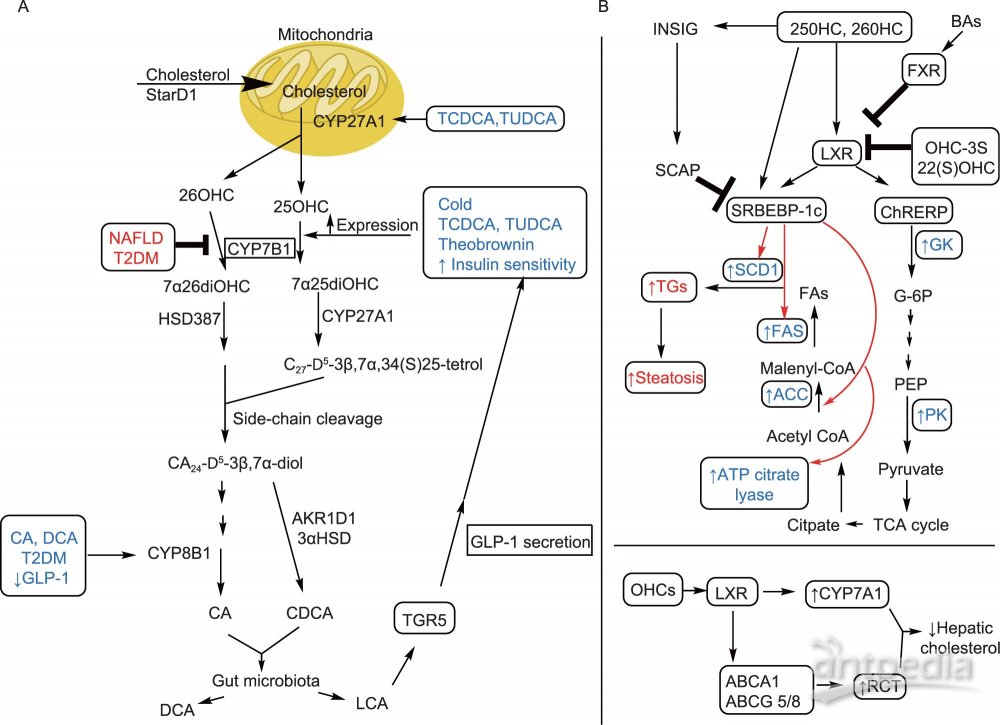
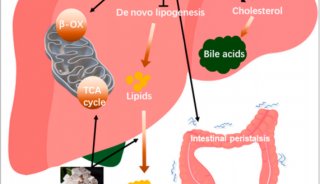
BA替代合成途径是羟化固醇(BA形成过程中的氧化中间体,重要的生物活性脂质)的主要来源。在替代途径中,胆固醇通过转运蛋白StARD1(类固醇激素合成急性调节蛋白1)进入肝线粒体,其中胆固醇被线粒体酶CYP27A1催化发生羟基化生成两种重要的调节性羟化固醇,即25-羟基胆固醇和26-羟基胆固醇(25HC,26HC)。羟化固醇的水平随细胞胆固醇水平增加而增加。羟化固醇可以直接激动肝脏LXR受体,或通过CYP7B1代谢生成CDCA。该途径不仅产生重要的正常生理功能的羟化固醇,还用于解毒作用。
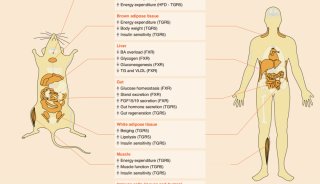
胆固醇从外周组织中移出并返回肝脏被称为胆固醇逆向转运(RCT)。RCT可以降低人体的胆固醇过量。羟化固醇激活的LXR能诱导多个RCT相关基因转录表达,包括ATP结合转运蛋白、ABCA1、ABCG1、ABCG5、ABCG8、载脂蛋白E(ApoE)、胆固醇酯转移蛋白、磷脂转移蛋白、清道夫受体B1和CYP7A1。羟化固醇活化的LXR还通过ChREBP(碳水化合物反应元件结合蛋白)和SREBP-1c促进脂肪酸从头合成的增加,诱导相关酶SCD-1、FAS、肝丙酮酸激酶(LPK)和乙酰辅酶A羧化酶1(ACC-1)高表达。羟化固醇与LXR的结合还通过降低糖异生酶、过氧化物酶体增殖物激活的受体-γ共激活因子1α、磷酸烯醇丙酮酸羧化酶(PEPCK)和葡萄糖-6-磷酸酶(G6Pase)的蛋白质表达来介导葡萄糖稳态。同时,羟化固醇可以不依赖LXR,直接与INSIG(胰岛素诱导基因蛋白)结合,使其与SREBP裂解激活蛋白(SCAP)相互作用,以防止SREBP-1c输出到细胞核并增加脂肪生成,从而进行反馈调节。
研究发现,25-OHC-3S(25-羟基胆固醇的硫酸盐)是LXR拮抗剂。高脂饮食(HFD)小鼠经25-OHC-3S处理后,HFD小鼠体重降低,肝脂质含量降低,葡萄糖耐量和胰岛素耐受性改善。在人肝细胞中,用25-OHC-3S处理后,脂肪酸从头合成相关基因(SREBP-1c,ACC和FAS)表达降低。25-OHC-3S处理的人类巨噬细胞,PPARγ蛋白水平增加和向核内易位,导致几种促炎基因的表达下降。
减少羟化固醇下游效应的另一方法是增强CYP7B1的表达和活性,以此降低羟化固醇水平,增加non-12OH BA如CDCA及其肠道菌下游产物LCA的水平。LCA类的BA通过激动TGR5,刺激肠内分泌L细胞分泌GLP-1。GLP-1分泌会增强胰腺β细胞的胰岛素分泌。胰岛素敏感性改善可增加CYP7B1的表达。如前文所述,HCA类BA同样能促进GLP-1的分泌,并诱导的CYP7B1表达。图2概括了替代途径(A)和羟化固醇/ LXR轴(B)调控脂质代谢中的作用。
替代途径与NAFLD / NASH、肝癌终末期
代谢性疾病NAFLD可发展为NASH并最终导致肝癌。19对临床HCC肿瘤组织和邻近的非肿瘤组织基因表达分析表明,负责HDL-固醇输入、胆固醇生物合成(HMGCR)和固醇磺化(SULT2B1b)的基因无显著差异。但是,在肿瘤组织中,参与固醇分解代谢的基因(CYP8B1,CYP27A1,CYP7B1,CYP39A1)和固醇通量的基因(ABCA1,ABCG5,ABCG8)显著降低,这表明肝癌中固醇显著增加。由于关键调节酶CYP27A1的减少,肿瘤组织通过BA替代途径产生的羟化固醇也可能减少。因此,提出一个假设,在NASH后期的伴随纤维化和肝硬化的癌前细胞是否可以通过上调BA合成的替代途径,提供外源性羟化固醇,调控疾病的发展。HCC在很大程度上依赖于羟化固醇用于细胞增殖、免疫抑制以促进肿瘤生长、新血管生成和脂肪生成。BA替代途径对于疾病的调控主要取决于CYP7B1的水平和活性。替代途径的升高一方面可能是羟化固醇的来源,促进肿瘤增殖;若羟化固醇下游的CYP7B1高表达,则产生更多的非12-OH BA(与更好的预后相关)。需要进行更多研究为BA替代合成途径在治疗和预防终末期肝病中的应用提供数据依据。
替代途径与胎儿肝脏代谢和生长
胎儿肝脏(FL)是维持和生成造血干细胞(HSC)重要部位。胎儿肝脏促进HSC快速扩增,而骨髓中HSC池仍停留在静止的骨髓造血微环境中。最近研究发现FL具有与母体肝脏截然不同的胆汁酸谱,这是由BA合成酶CYP27A1和CYP8B1相对丰度所决定。CYP7A1在FL中的表达水平低于母体肝脏中的表达水平。尽管FL尚不存在胆管结构,但FL中BA可通过阻止聚集的未折叠蛋白的产生来抑制应激信号。FL中次级BA的发现,表明母体BA可以通过胎盘自由转运到FL中。对胎儿羊水的研究揭示在胎儿早期也可检测到的BA。如果母体和胎儿血浆中BA过量,则称为肝内胆汁淤积症(ICP),这会增加胎儿窒息、早产甚至自发性胎儿死亡的风险。在ICP中,母体高水平的BA向胎儿转移,还可能竞争性地抑制胎儿BA向母体转移,从而导致母体BA在胎儿血液循环积累。ICP的治疗方式包括给予UDCA。已报道UDCA可以减少细胞凋亡和BA诱导的氧化应激以及对胎盘滋养层细胞的其他炎症作用。UDCA也可以阻断BA转运蛋白OATP4A1,从而阻止母体BA吸收。对BA在FL中的作用及其代谢通路的了解有助于理解成年肝脏中BA替代合成途径的作用。
替代途径与肠道菌群
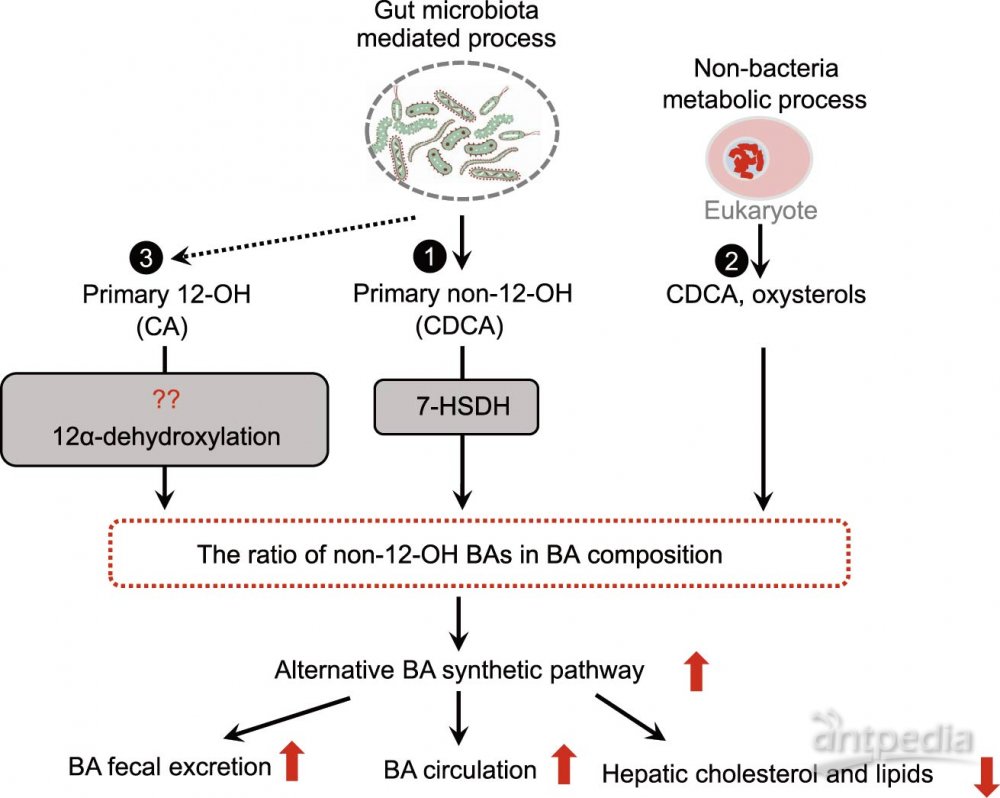
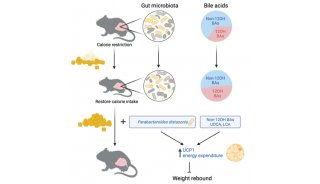
除了补充外源性CDCA以增加非12-OH BA之外,肠道菌群也可操纵BA合成的替代途径(图3)。

肠道菌群可通过改变BA组成和非12-OH BA的比例诱导肝脏合成具有不同位置羟基的BAs。已报道,无菌(GF)小鼠对HFD诱导的肥胖具有抵抗力。与常规饲养的(CONV-R)小鼠相比,GF小鼠BA池中非-12-OH Bas,特别是TβMCA的比例显著增加, CYP7A1和CYP7B1表达增加,而非CYP8B1表达增加, FGF15水平降低。类似的,用抗生素抑制小鼠肠道菌群时,FGF15水平降低,而TβMCA/ CA比值显著增加,表明BA合成的替代途径激活。向野生型小鼠中注射FGF15可显著抑制CYP7A1的表达,但不影响CYP8B1表达。CYP7A1是BA合成的限速酶,也参与CDCA的合成,这是经典途径和替代途径之间的重合部分。肠道菌群调节肠道FXR-FGF15信号传导对BA合成的替代途径产生影响。肠道和肝脏的FXR信号对BA动态平衡调节作用不同,CYP7A1更容易被肠道FXR-FGF15途径调节,而CYP8B1对肝脏FXR激活更敏感。由此推测, FGF15水平降低主要通过替代途径增强BA合成,从而导致BA组成改变。
改变BA组成的另一种机制可能涉及表达7-HSDH的肠道细菌,例如梭状芽胞杆菌家族,它们在肠道中诱导BA 7-羟基发生异构化将CDCA转化为UDCA。对于这些肠道菌群而言,更易于亲和并代谢两个OH的 BA(例如CDCA和UDCA),而非三个OH的 BA(例如CA)。这些微生物优先将CDCA代谢为UDCA, UDCA进一步激活替代途径,加速BA循环和粪便排泄。在小鼠研究中发现,口服产7-HSDH的细菌可上调替代途径BA生成并提高血清C4水平。
同时,BAs也会影响宿主肠道菌群的组成。正常饮食喂养的小鼠在CA(人胆汁中最丰富的12-OH BA)给予后肠道菌群的变化与高脂饮食喂养的小鼠中的肠道菌群变化相似,厚壁菌/拟杆菌的比例增加。因此,由肠道菌群介导的BA调节可以进一步重新肠道菌群。
小结
本综述总结了BA合成途径,合成通路中产生的非-12-OH BA和羟化固醇将激活各组织中多个核和膜受体介导的信号通路。这些非12-OH的BA包括了CDCA、UDCA、HCA、LCA、MCA,及其甘氨或牛磺结合型BA,这些BA最终调节肥胖、T2DM、NAFLD、NASH、肝癌等疾病的发生和发展。非12-OH BA可以通过饮食补充、肝脏代谢、菌群进行调控,其中肠道菌群催化BA 7-羟基的异构化,将非12-OH BA(CDCA)转化为UDCA。尚不清楚肠道细菌是否表达12α-脱羟基酶(该酶会将12-OH BA转化为非12-OH BA),也将是未来的研究方向。“肠道微生物-BA对话机制”在调节葡萄糖和脂代谢中的作用也需要进一步研究。因此,需要更系统和更深入理解肠道菌群与宿主系统功能的关系,才能探索新的疾病干预策略。
配套检测方法
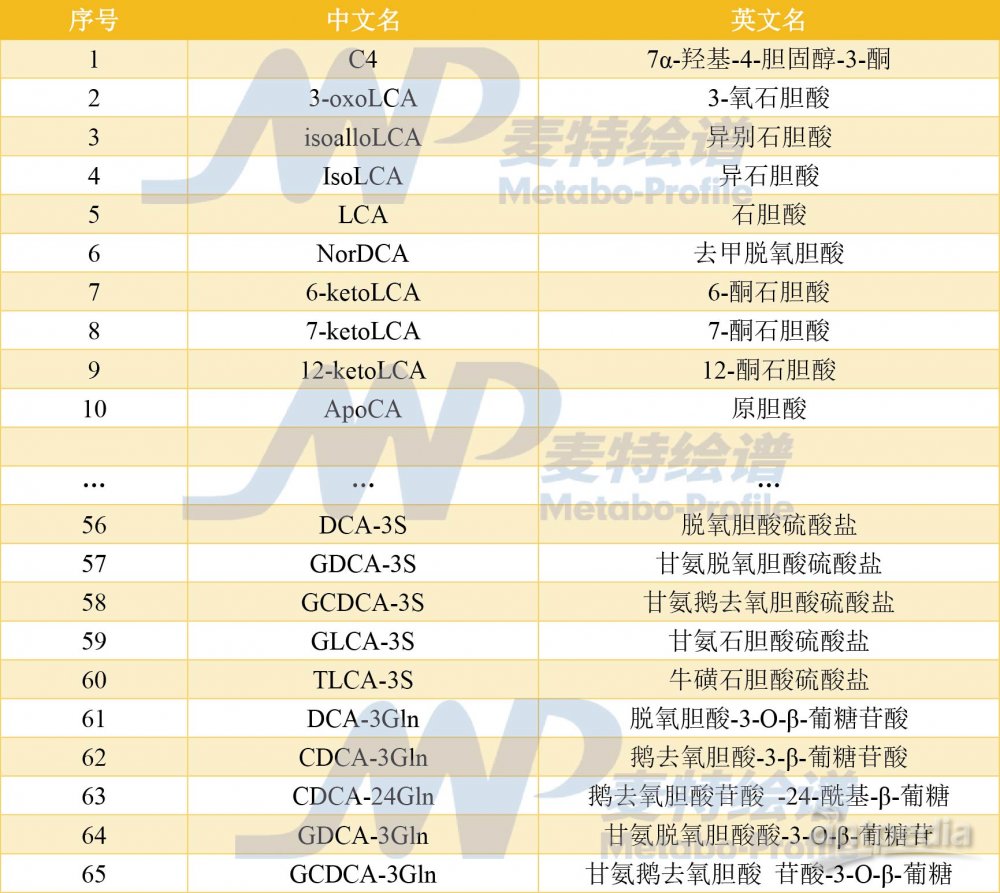
本文涉及的胆汁酸类代谢物,麦特绘谱均可提供全套解决方案!麦特绘谱胆汁酸相关检测包括胆汁酸全谱检测、胆汁酸简谱检测、Q300检测、宏代谢检测。其中,胆汁酸全谱分析平台可确保多种胆汁酸同分异构体获得较好的分离,并以10+同位素标记胆汁酸为内标可在多个物种、多种生物样本中精确定量60+种胆汁酸,部分检测列表如下:
参考文献
Jia W, et al. Targeting the alternative bile acid synthetic pathway for metabolic diseases. Protein Cell. 2020. doi: 10.1007/s13238-020-00804-9.
原文阅读,请长按识别下方二维码

关于麦特绘谱
麦特绘谱生物科技(上海)有限公司(Metabo-Profile),专注于精准医学和健康领域的代谢组学技术服务,致力于成为全球代谢组学研究者的首选合作伙伴。
麦特绘谱拥有全套高端质谱检测平台,凭借自身在精准医学和健康领域的代谢组学技术及转化经验,研发了靶向定量、代谢芯片、非靶向、代谢流等十几种代谢组学检测方法及科研试剂盒,利用静态及动态分析,来深入解读疾病的病理机制、治疗靶点的发现和验证、药物的作用及毒性研究等,大量的临床研究数据积累为代谢组产业化提供了夯实的基础。
精彩推荐
2. Cell Metabolism | 肠道菌群相关代谢物--胆汁酸生物学功能
3. Nature Communications │ 普洱茶通过影响肠-肝对话发挥减肥降脂的功效
4. Protein & Cell︱结直肠癌(CRC)和肝细胞癌(HCC)的肠道菌群差异
5. 肠·道 | 贾伟:肝病肠治?且看肠道细菌如何对肝病推波助澜!
6. 贾伟/李后开: “肠道菌-胆汁酸-脑”代谢轴可能参与阿尔茨海默病和肝性脑病的发病机制
7. Gut Microbes | 李后开教授团队在“肠道菌-胆汁酸代谢轴”与衰老的关系研究中取得新进展
8. 综述 | Cell子刊:胆汁酸-微生物互作及对宿主代谢的影响

-
仪器推荐
 询底价 Tel:400-6699-117 转 7875
询底价 Tel:400-6699-117 转 7875 -
仪器推荐
-
仪器推荐

-
仪器推荐
-
仪器推荐
-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章

-
厂商文章
-
厂商文章
-
厂商文章
-
厂商文章

-
厂商文章

-
厂商文章