Nature Metabolism | 胆汁酸新功能--通过肠脑轴影响食欲
胆汁酸(BAs)除了促进脂类消化吸收外,还可作为信号分子调控代谢和免疫等多种生理功能。细胞表面的Takeda G蛋白偶联受体5(TGR5,又称GPBAR1)是BAs的主要受体,它们在肠道、肾脏、肝脏以及中枢神经系统等部位均有表达。近些年有报道显示,大脑中存在BAs,并与循环BAs水平高度相关,可通过被动扩散到达中枢神经系统(CNS),但人们对BAs在CNS中的生理作用却知之甚少。来自瑞士洛桑理工学院的Kristina Schoonjans团队发现,小鼠生理进食后BAs到达下丘脑,使下丘脑BAs浓度短时上调,特异性激活AgRP/NPY神经元膜受体TGR5的表达,进而调控小鼠食欲,揭示了BA-TGR5信号在中枢神经系统中介导的生理反馈作用。这一发现给肥胖治疗提供了新思路。相关成果发表在《Nature Metabolism》。
中枢神经系统BA-TGR5信号可调控小鼠进食行为
作者首先发现野生型小鼠生理进食后,BAs进入到下丘脑,几种内源性BAs(主要是牛磺酸结合型)浓度短时升高。给小鼠口服混合BAs后,小鼠全天食物摄入量减少,表明CNS中由饮食介导的BAs增加可能通过激活BA受体在禁食-进食过渡期间触发饱腹感。利用RNAscope脑表达谱发现内源Gpbar1 mRNA在控制食欲的下丘脑弓状核(ARC)区高表达。给小鼠灌胃TGR5特异性半合成BA INT-777,发现INT-777与内源BA一样在下丘脑迅速积累。并可在10-100 mg /kg剂量范围内减少食物摄入,在最高剂量下,INT-777 到达下丘脑的浓度与餐后内源性BA 的浓度相当,概括了BA介导的摄食行为反馈调节所需的中枢生理浓度。在参与摄食调节的不同神经元群体中,促食欲AgRP/NPY神经元和抑食欲POMC神经元位于ARC中,靠近有孔的血脑屏障,可促进与血液的交换。ARC内神经肽表达显示,小鼠口服或静脉注射TGR5激动剂1 h后,Agrp和Npy mRNA水平降低,而Pomc水平不受影响。

图1 生理喂养过程中BAs到达下丘脑,并通过TGR5抑制进食
分析野生型(Gpbar1+/+)和TGR5完全敲除型(Gpbar1−/−)小鼠的表型发现,Gpbar1−/−小鼠总进食量显著增加、夜间进食量显著增加,并且不能抑制Agrp和Npy –促食欲神经肽的表达,而抑食欲神经肽Pomc的表达不受影响,表明在喂食状态下TGR5可能通过抑制AgRP/NPY而不是刺激POMC神经元来协调饱腹感。进一步分析TGR5在大脑不同细胞类型中的分布,免疫荧光分析显示,TGR5存在于下丘脑神经元以及其他脑细胞中,包括神经胶质细胞和星形胶质细胞。用神经元特异性TGR5敲除小鼠重复该实验发现,小鼠的总进食量和促食欲神经肽分泌量也显著增加。
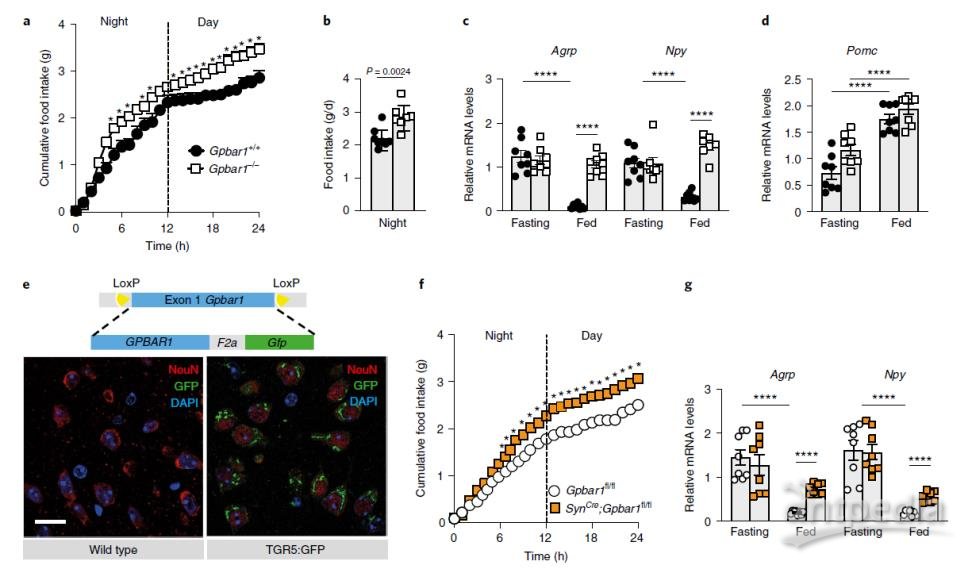
图2 神经元中TGR5的表达,其缺失会促进食物摄入
TGR5通过抑制下丘脑AgRP/NPY神经元来抑制食物摄入
为了进一步证实上述结论,作者分别构建了AgRP和POMC神经元特异性敲除Gpbar1的小鼠模型,和野生型小鼠相比,AgRP突变小鼠在夜间进食量显著增加,而POMC突变小鼠的进食量无变化。此外,口服INT-777后,POMC突变小鼠和野生型小鼠产生厌食反应,而这种效应在AgRP突变小鼠中显著减弱,表明TGR5通过AgRP/NPY神经元,而不是POMC神经元来控制食物摄入。在 TGR5:GFP 小鼠中使用 Agrp RNAscope 探针和 GFP 免疫荧光共染色实验,结果显示,TGR5在AgRP /NPY神经元中表达。免疫荧光实验表明,禁食动物中 INT-777 介导的 TGR5 激活显著降低了Fos阳性AgRP/NPY神经元的百分比。这些结果表明BA-TGR5信号通过抑制下丘脑AgRP/NPY神经元中神经肽的表达来抑制进食行为。
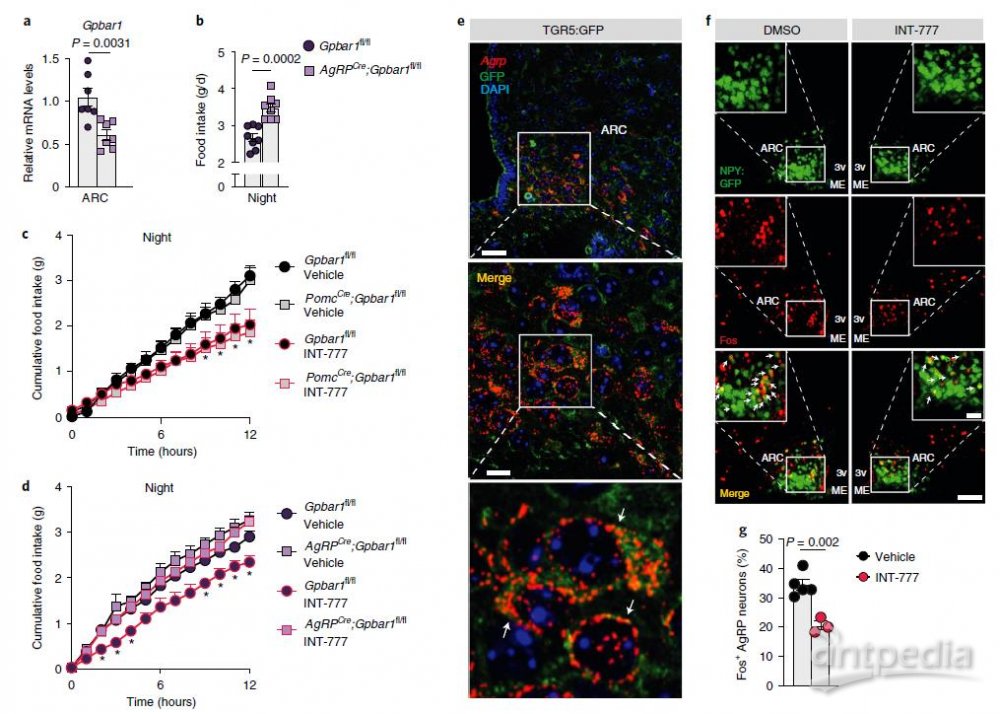
图3 AgRP/NPY中的TGR5选择性缺失可消除BA衍生物诱导的饱腹感
机制探究:TGR5能瞬时性地阻断AgRP/ NPY神经元神经肽的释放
由于TGR5能介导快速神经元的反应,作者推断TGR5除了抑制促食欲基因表达,还可能参与阻断神经肽的分泌。下丘脑外植体离体实验表明,禁食后,用INT-777激活TGR5可迅速抑制Gpbar1+/+的AgRP/NPY神经元中AgRP和NPY的释放,但在Gpbar1-/-中无该效应。这些结果表明进食后BA-TGR5信号的生理厌食作用是通过选择性减少AgRP/NPY分泌来实现的。
进一步探究其分子机制,作者用AgRP/ NPY阳性且表达TGR5的小鼠胚胎下丘脑细胞系mHypoE-N41 (N41)进行了一系列实验,与体内和离体研究结果一致, INT-777处理能快速降低N41细胞中Agrp和Npy的表达,并短时阻断了Agrp的释放。
已有证据表明,在致密核心囊泡(DCVs)动员的早期阶段,皮质肌动蛋白丝是分泌囊泡和质膜之间的主要物理屏障,肌动蛋白网络重塑可限制不同类型细胞(包括神经元)的肽分泌。肌动蛋白的解聚合和稳定性可通过Rho–ROCK信号通路来调节。那么,TGR5是否通过Rho–ROCK–肌动蛋白轴瞬时调节神经肽的分泌?通过评估INT-777 处理后的 AgRP 和 NPY 分泌以及同时使用thiazovivin 抑制ROCK。ROCK的抑制消除了TGR5对AgRP和NPY分泌抑制。此外,用INT-777或BA混合物短期刺激TGR5可调节细胞骨架,有利于肌动蛋白纤维的稳定和聚合。与以上研究结果一致,用INT-777或BA混合物急性激活TGR5后,N41细胞内NPY小泡的积累增加、释放明显减少;机制上,BA-TGR5信号可以促进ROCK下游蛋白MLC和COFILIN的瞬时磷酸化进而促进肌动蛋白的稳定和聚合。这些结果表明BA-TGR5信号可以降低AgRP/NPY mRNA的丰度,并暂时阻断AgRP/ NPY神经元中神经肽的释放,进而抑制进食行为。
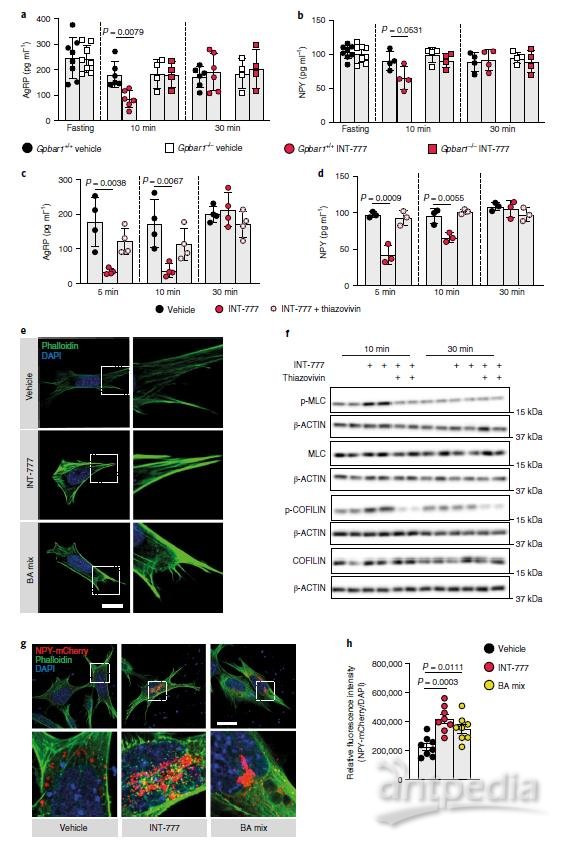
图4 TGR5通过Rho–ROCK信号通路的短暂激活调控促食欲神经肽的释放
小结
BAs作为多功能信号分子,调节肝肠和外周代谢器官之间的交流,近些年研究表明BAs在全身代谢和免疫调节方面具有重要作用。本研究发现BA-TGR5信号轴不仅在疾病中起重要作用,而且在进食行为的生理控制中也起着重要作用。BAs在下丘脑中通过结合AgRP/NPY神经元上的TGR5受体抑制AgRP/NPY mRNA表达和神经肽释放,从而抑制进食行为,揭示了BAs在神经调节方面的新功能。
绘谱帮你测
肠脑轴研究中一般关注较多的代谢物有神经递质、短链脂肪酸、激素等,而本研究发现胆汁酸及其受体在肠脑轴调控食欲方面具有重要作用。针对胆汁酸代谢,麦特绘谱可绝对定量检测65种胆汁酸,此外,我们可提供代谢组学一站式整体解决方案,独家的检测技术、全面的数据报告以及专业的售后探讨,助力您的科研探索之路不断创新和突破。欢迎联系获取详细资料!
参考文献
Alessia Perino, et al. Central anorexigenic actions of bile acids are mediated by TGR5. Nature Metabolism, VOL 3 , MAY 2021 ,595–603.
原文阅读,请长按识别下方二维码

精彩推荐
4. Protein&Cell | 胆汁酸替代合成途径与代谢性疾病
5. Cell Metabolism | 肠道菌群相关代谢物--胆汁酸生物学功能
6. Nature Medicine│胆汁酸-肠道菌群调控多囊卵巢综合征的新机制
7. Cell Host & Microbe | 石胆酸通过重塑肠肝轴改善减肥手术后糖尿病